Sezioni di tossicologia
Tossimetria: valutazione quantitativa della tossicità, misurazione della relazione dose-risposta.
Tossicodinamica: lo studio dei meccanismi alla base degli effetti tossici di varie sostanze chimiche, i modelli di formazione del processo tossico, le sue manifestazioni.
Tossicocinetica: chiarimento dei meccanismi di penetrazione delle sostanze tossiche nel corpo, modelli di distribuzione, metabolismo ed escrezione.
La tossicità dipende dalla dose e dall’esposizione. Anche da isomeri. Isomeri tione e tiolo del FOS. Introduzione dei gruppi toxoforici.
Meccanismi di tossicità
Modi di penetrazione dei pesticidi nel corpo degli animali e dell'uomo.
1. Distribuzione
Muoversi attraverso la componente idrica del corpo (sistemi linfatico e circolatorio). Le sostanze lipofile vengono escrete più difficilmente di quelle idrofile.
Fattori che influenzano il tasso di distribuzione:
La velocità del flusso sanguigno al tessuto
Peso del tessuto
La capacità di una sostanza di muoversi attraverso le membrane
L'affinità di una sostanza per i tessuti rispetto al sangue.
1. Interazione con la scena
2. Distruzione cellulare, danno
3. Morte o restaurazione
Meccanismi che promuovono il movimento del sangue verso il sito d'azione:
Porosità dei capillari
Trasporto specifico attraverso le membrane
Accumulo negli organelli cellulari
Legame intracellulare reversibile
Movimento impedito:
Legame con le proteine plasmatiche (CHOS) - albumina, beta-globulina, ceruloplasmina, alfa e beta lipoproteine, alfa-glicoproteina acida.
Barriere specifiche (ematoencefaliche e placentari).
Uno strato di cellule gliali che ricopre la superficie dei capillari. Da un lato vengono lavati dal sangue, dall'altro dal fluido intercellulare.
Barriera placentare: diversi strati di cellule tra il fluido intrafetale e il sistema circolatorio materno. Lipofilo: per diffusione, il sistema nervoso centrale è responsabile della biotrasformazione.
Accumulo nei tessuti di riserva (CHOS nelle cellule adipose; piombo - tessuto osseo).
Legame ad un sito d'azione non specifico (FOS - butirrilcolinesterasi)
Esporta da cella
Legame da parte di organi, tessuti: il fegato e i reni hanno un'elevata capacità legante. Il tessuto adiposo: CHOS, piretroidi. Tessuto osseo: fluoro, piombo, stronzio.
Effetti tossici, classificazione della tossicità
Impatto sulla scena:
La sostanza tossica può interrompere la funzione della molecola o distruggerla:
Disfunzione - inibizione: i piretroidi bloccano la chiusura dei canali ionici, i benzimidazoli bloccano la polimerizzazione della tubulina.
Violazione delle funzioni delle proteine: reazione con gruppi tiolici di proteine (ftalimmidi); interruzione delle funzioni del DNA mutageni, cancerogeni.
Impatto sulla scena:
Distruzione della molecola:
Alterazione della molecola mediante reticolazione e frammentazione: il disolfuro di carbonio e gli agenti alchilanti reticolano le proteine citoscheletriche, il DNA
Degradazione spontanea: i radicali liberi avviano la degradazione dei lipidi eliminando l'idrogeno dagli acidi grassi
Effetti acuti:
Dermatotossicità:
La proprietà di una sostanza chimica di danneggiare la pelle per contatto diretto o per azione di riassorbimento dovuta alla penetrazione della sostanza chimica nel corpo con lo sviluppo di effetti sistemici.
La dermatite chimica è un processo che si sviluppa di conseguenza impatto locale tossico e accompagnato da una reazione infiammatoria
Contatto non allergico: può essere irritante (effetto citotossico) e cauterizzante (distruzione dei tessuti tegumentari). Irritante - solventi organici, ditiocarbammati.
Contatto allergico - dopo un contatto relativamente prolungato.
Il tossicoderma è un processo patologico nella pelle, che si forma a seguito dell'azione di riassorbimento di una sostanza tossica. La malattia è la cloracne.
La pneumotossicità è la proprietà di una sostanza tossica di causare disturbi respiratori.
Irritazione - ammoniaca, cloro, fosfina.
Necrosi cellulare - polmonite, edema polmonare (cadmio, FOS, anidride solforosa, paraquat, diclorometano, cherosene).
Fibrosi (formazione di tessuti di collagene) - silicosi, asbestosi.
Enfisema - ossido di cadmio, ossidi di azoto, ozono.
Ematotossicità: la proprietà di una sostanza tossica di interrompere la funzione delle cellule del sangue o la composizione cellulare del sangue.
Violazione delle proprietà dell'emoglobina, anemia, aplasia midollo osseo.
La metaemoglobina è l'emoglobina, il cui ferro è trivalente. Il suo livello è inferiore all'1%. La metaemoglobinemia si sviluppa sotto l'azione di xenobiotici, che ossidano direttamente il ferro, che fa parte della struttura dell'emoglobina, o vengono convertiti in agenti simili nel corpo. La velocità di formazione della metaemoglobina supera la velocità di formazione dell'emoglobina. Dinitrofenoli, naftilammine, ecc.
La carbossiemoglobinemia è la formazione della sostanza corrispondente nel sangue sotto l'influenza di CO e carbonili metallici.
L'emolisi è accompagnata da:
1. Aumento del contenuto delle proprietà colloido-osmatiche del sangue dovuto all'aumento del contenuto proteico.
2. Distruzione accelerata dell'emoglobina.
3. Difficoltà nella dissociazione dell'ossiemoglobina.
4. Effetto nefrotossico dell'emoglobina.
Malattie:
L’aplasia del midollo osseo è una riduzione del numero delle cellule del sangue.
trombocitopenia e leucemia.
Neurotossicità: la capacità di un pesticida di interrompere l'azione del sistema nervoso nel suo insieme. Siti d'azione: neurone, assone, rivestimento mielinico delle cellule, sistema di trasmissione degli impulsi nervosi.
Neurone - neuronopatia (morte dei neuroni). Sostanze: arsenico, azidi, cianuri, etanolo, metanolo, piombo, mercurio, metilmercurio, bromuro di metile, trimetilstagno, FOS.
Assone - assonopatia. Acrilammide, disolfuro di carbonio, clordecano, diclorofenossiacetato, FOS, piretroidi, esano.
La mielinopatia è un danno allo strato mielinico. Piombo, triclorfon.
Violazione dell'azione del sistema nervoso: COS, piretroidi, avermectine, fenilpirazodi, micotossine, tossine degli artropodi.
Epatotossicità: proprietà delle sostanze chimiche di causare disturbi strutturali e funzionali del fegato. Danno:
Degenerazione grassa. La comparsa precoce precede la necrosi. Cause:
Violazione dei processi di catabolismo lipidico
Troppi acidi grassi nel fegato
Danni ai meccanismi di rilascio dei trigliceridi nel plasma sanguigno
La necrosi epatica è un processo degenerativo che porta alla morte cellulare. Parzialmente necrosi focale, completamente necrosi totale. Accompagnato da danni membrane plasmatiche e steatosi. Sostanze tossiche: idrocarburi alfa e aromatici, nitrocomposti, nitrosammine, aflatossine.
La colestasi è una violazione del processo di secrezione biliare. Sostanze tossiche: farmaci (sulfamidici, estradiolo), aniline.
La cirrosi è la formazione di filamenti di collagene che si interrompono struttura normale organo che interrompe il flusso sanguigno intraepatico, la secrezione biliare. Etanolo, alocarburi.
Cancerogenesi
Nefrotossicità: la capacità di un pesticida di interrompere i disturbi strutturali e funzionali dei reni. E
La cromatografia è un metodo per la separazione e la determinazione di sostanze basato sulla separazione dei componenti tra due fasi. Una sostanza solida porosa (assorbente) o una pellicola di liquido su una sostanza solida funge da elemento fisso. La fase mobile è un liquido o un gas che scorre attraverso una fase stazionaria (a volte sotto pressione). I componenti della miscela analizzata (sorbati), insieme alla fase mobile, si muovono fase stazionaria. Di solito è posizionato in un tubo di vetro o metallo chiamato colonna. A seconda della forza dell'interazione con la superficie assorbente dovuta all'adsorbimento o ad un altro meccanismo, i componenti si muovono lungo la colonna con velocità diversa. Alcuni componenti rimarranno nello strato superiore dell'assorbente, mentre altri, interagendo in misura minore con l'assorbente, si troveranno nella parte inferiore della colonna. E alcuni lasceranno del tutto la colonna con la fase mobile. Successivamente, le sostanze entrano nel rilevatore. I rilevatori di ionizzazione più utilizzati, il cui principio di funzionamento si basa su una variazione della corrente ionica. Avviene sotto l'influenza di una fonte di ionizzazione - campo elettrico tra gli elettrodi del rilevatore. Vengono utilizzate le seguenti sorgenti di ionizzazione: emissione di ioni elettronici, isotopi radioattivi, scarica elettrica.
L'interazione di una sostanza tossica o dei prodotti della sua trasformazione nel corpo con gli elementi strutturali dei biosistemi, che è alla base del processo tossico in via di sviluppo, è chiamata meccanismo dell'azione tossica. L'interazione viene effettuata a causa di reazioni fisico-chimiche e chimiche.
Il processo tossico avviato dalle reazioni fisico-chimiche, di regola, è causato dalla dissoluzione della sostanza tossica in determinati mezzi (acquosi o lipidici) delle cellule e dei tessuti del corpo. In questo caso, le proprietà fisico-chimiche del mezzo solvente (pH, viscosità, conduttività elettrica, forza delle interazioni intermolecolari, ecc.) Cambiano in modo significativo. Peculiarità di questo tipo interazioni: l'assenza di una stretta dipendenza della qualità dell'effetto di sviluppo dalle proprietà chimiche della molecola tossica. Pertanto, tutti gli acidi, gli alcali, i forti agenti ossidanti, alcuni solventi organici e i composti macromolecolari privi di attività specifica agiscono sui tessuti.
Più spesso, l'effetto tossico si basa sulle reazioni chimiche di una sostanza tossica con un determinato elemento strutturale di un sistema vivente. La componente strutturale di un sistema biologico con cui una sostanza tossica entra in interazione chimica è chiamata "recettore" o "bersaglio".
I meccanismi dell’azione tossica della stragrande maggioranza delle sostanze chimiche sono attualmente sconosciuti. A questo proposito, molte delle classi di molecole e complessi molecolari che compongono l'organismo, descritte di seguito, sono considerate, per la maggior parte, solo come probabili recettori (bersagli) dell'azione dei veleni. Considerarli in questa prospettiva è legittimo, poiché l'azione di alcune sostanze tossiche ben studiate si basa sull'interazione con rappresentanti di queste particolari classi di biomolecole.
1. Definizione del concetto di "recettore" in tossicologia
Il concetto di "recettore" è molto capiente. Molto spesso in biologia è usato nei seguenti sensi:
1. Concetto generale. I recettori sono siti di legame relativamente specifico sul biosubstrato degli xenobiotici (o molecole endogene), a condizione che il processo di legame obbedisca alla legge dell'azione di massa. Intere molecole di proteine, acidi nucleici, polisaccaridi, lipidi o loro frammenti possono agire come recettori. Per quanto riguarda un frammento di una biomolecola direttamente coinvolto nella formazione di un complesso con una sostanza chimica, viene spesso utilizzato il termine "regione recettore". Ad esempio, il recettore del monossido di carbonio nel corpo è la molecola di emoglobina e la regione del recettore è lo ione ferroso racchiuso nell'anello porfirinico dell'eme.
2. Recettori selettivi. Con la complessità evolutiva degli organismi, si formano speciali complessi molecolari: elementi di sistemi biologici che hanno un'elevata affinità per le singole sostanze chimiche che svolgono le funzioni di bioregolatori (ormoni, neurotrasmettitori, ecc.). Le aree dei sistemi biologici che hanno la massima affinità per i singoli bioregolatori speciali sono chiamate "recettori selettivi". Le sostanze che interagiscono con i recettori selettivi secondo la legge dell'azione di massa sono chiamate ligandi dei recettori selettivi. L'interazione dei ligandi endogeni con i recettori selettivi è di particolare importanza per il mantenimento dell'omeostasi.
Molti recettori selettivi sono composti da diverse subunità, di cui solo una frazione ha siti di legame con il ligando. Spesso il termine "recettore" viene utilizzato per riferirsi solo a tali subunità che legano il ligando.
3. I recettori permanenti sono recettori selettivi, la cui struttura e proprietà sono codificate utilizzando geni speciali o complessi genetici permanenti. A livello fenotipico, il cambiamento nel recettore dovuto alla ricombinazione genetica è estremamente raro. I cambiamenti nella composizione aminoacidica della proteina che forma il recettore selettivo, che a volte si verificano nel corso dell'evoluzione a causa di trasformazioni poligenetiche, di norma hanno scarso effetto su caratteristiche funzionali quest'ultimo, la sua affinità per ligandi endogeni e xenobiotici.
I recettori permanenti includono:
Recettori per neurotrasmettitori e ormoni. Come altri recettori selettivi, anche questi recettori sono in grado di interagire selettivamente con alcuni xenobiotici (farmaci, sostanze tossiche). Gli xenobiotici possono agire sia come agonisti che come antagonisti dei ligandi endogeni. Di conseguenza, viene attivata o soppressa una certa funzione biologica, che è sotto il controllo di questo apparato recettoriale;
Gli enzimi sono strutture proteiche che interagiscono selettivamente con i substrati di cui catalizzano la conversione. Gli enzimi possono anche interagire con sostanze estranee, che in questo caso diventano inibitori o regolatori allosterici della loro attività;
Proteine di trasporto: legano selettivamente ligandi endogeni di una determinata struttura, eseguendo la loro deposizione o trasferimento attraverso varie barriere biologiche. Le sostanze tossiche che interagiscono con le proteine di trasporto agiscono anche come loro inibitori o come regolatori allosterici.
4. Recettori con struttura mutevole. Si tratta principalmente di anticorpi e recettori leganti l'antigene dei linfociti T. Recettori di questo tipo si formano nelle cellule precursori delle forme cellulari mature a causa dell'indotto influenze esterne ricombinazione di 2 - 5 geni che ne controllano la sintesi. Se la ricombinazione ha avuto luogo nel processo di differenziazione cellulare, negli elementi maturi verranno sintetizzati solo i recettori di una determinata struttura. In questo modo si formano recettori selettivi per ligandi specifici e la proliferazione porta alla comparsa di un intero clone di cellule contenenti questi recettori.
Come risulta dalle definizioni sopra riportate, in biologia il termine "recettore" viene utilizzato principalmente per indicare strutture direttamente coinvolte nella percezione e trasmissione dei segnali biologici e in grado di legarsi selettivamente, oltre ai ligandi endogeni (neurotrasmettitori, ormoni, substrati), alcuni composti estranei.
In tossicologia (così come in farmacologia), il termine "recettore" si riferisce a qualsiasi elemento strutturale di un sistema vivente (biologico) con il quale una sostanza tossica (farmaco) interagisce chimicamente. In questa interpretazione, questo concetto è stato introdotto in chemiobiologia all'inizio del XX secolo da Paul Ehrlich (1913).
La gamma di caratteristiche energetiche dell'interazione recettore-ligando è insolitamente ampia: dalla formazione di legami deboli e facilmente spezzabili, alla formazione di complessi irreversibili (vedi sopra). La natura dell'interazione e la struttura del complesso formato dipendono non solo dalla struttura dell'agente tossico, dalla conformazione del recettore, ma anche dalle proprietà del mezzo: pH, forza ionica, ecc. Secondo la legge dell'azione di massa, il numero di complessi sostanza-recettore formati è determinato dall'energia di interazione (affinità) e dal contenuto di entrambi i componenti della reazione (sostanza e suo recettore) nel sistema biologico.
I recettori possono essere "silenziosi" e attivi. Recettore "silenzioso" - componente strutturale un sistema biologico, la cui interazione con una sostanza non porta alla formazione di una risposta (ad esempio, il legame dell'arsenico da parte delle proteine che compongono i capelli, le unghie). Un recettore attivo è un componente strutturale di un sistema biologico la cui interazione con una sostanza tossica avvia un processo tossico. Per evitare difficoltà terminologiche, al posto del termine "recettore" viene spesso utilizzato il termine "struttura bersaglio" per designare gli elementi strutturali, interagendo con i quali la sostanza tossica avvia il processo tossico.
Sono accettati i postulati:
L'effetto tossico di una sostanza è tanto più pronunciato quanto maggiore è il numero di recettori attivi (strutture bersaglio) che hanno interagito con la sostanza tossica;
La tossicità di una sostanza è tanto maggiore quanto minore è la sua quantità che si lega ai recettori "silenziosi", tanto più efficacemente agisce sul recettore attivo (struttura bersaglio), quanto più importanti sono il recettore e il sistema biologico danneggiato per il mantenimento dell'omeostasi della sostanza. intero organismo.
Qualsiasi cellula, tessuto, organo contiene un numero enorme di potenziali recettori. vari tipi("innescare" varie reazioni biologiche) con cui i ligandi possono interagire. Alla luce di quanto sopra, il legame di un ligando (sia una sostanza endogena che uno xenobiotico) ad un dato tipo di recettore è selettivo solo in un certo intervallo di concentrazioni. Un aumento della concentrazione di un ligando in un biosistema porta ad un ampliamento della gamma di tipi di recettori con cui interagisce e, di conseguenza, a un cambiamento nella sua attività biologica. Questa è anche una delle disposizioni fondamentali della tossicologia, dimostrata da numerose osservazioni.
I bersagli (recettori) per gli effetti tossici possono essere:
Elementi strutturali dello spazio intercellulare;
Elementi strutturali delle cellule del corpo;
Elementi strutturali di sistemi di regolazione dell'attività cellulare.
2. Azione del tossico sugli elementi dello spazio intercellulare
Ogni cellula del corpo è circondata da un mezzo acquoso: fluido interstiziale o intercellulare. Per le cellule del sangue, il fluido intercellulare è il plasma sanguigno. Le principali proprietà del fluido intercellulare: la sua composizione elettrolitica e una certa pressione osmotica. La composizione dell'elettrolito è determinata principalmente dal contenuto di ioni Na+, K+, Ca2+, Cl-, HCO3-, ecc.; pressione osmotica: presenza di proteine, altri anioni e cationi. Il fluido intercellulare contiene numerosi substrati per il metabolismo cellulare, prodotti del metabolismo cellulare, molecole che regolano l'attività cellulare.
Una volta nel fluido intercellulare, la sostanza tossica può modificare le sue proprietà fisiche e chimiche, entrare in interazione chimica con i suoi elementi strutturali. Un cambiamento nelle proprietà del fluido interstiziale porta immediatamente ad una reazione da parte delle cellule. Sono possibili i seguenti meccanismi di azione tossica, dovuti all'interazione della sostanza tossica con i componenti del fluido intercellulare:
1. Effetti elettrolitici. Si osserva una violazione della composizione elettrolitica in caso di avvelenamento con sostanze in grado di legare ioni. Quindi, con l'intossicazione da fluoruri (F-), alcuni agenti complessanti (Na2EDTA, DTPA, ecc.), altri agenti tossici (glicole etilenico, che metabolizza con formazione di acido ossalico), gli ioni calcio si legano nel sangue e nel liquido interstiziale, si sviluppa ipocalcemia acuta, accompagnata da disturbi del sistema nervoso, attività, tono muscolare, coagulazione del sangue, ecc. La violazione dell'equilibrio ionico, in alcuni casi, può essere eliminata introducendo soluzioni elettrolitiche nel corpo.
2. Effetti del pH. L'intossicazione da una serie di sostanze, nonostante l'elevata capacità tampone del fluido intercellulare, può essere accompagnata da una significativa violazione delle proprietà acido-base dell'ambiente interno del corpo. Pertanto, l'avvelenamento da metanolo porta all'accumulo di acido formico nel corpo, causando una grave acidosi. Un cambiamento nel pH del liquido interstiziale può anche essere una conseguenza di effetti tossici secondari e svilupparsi a seguito di una violazione dei processi bioenergetici, emodinamici (acidosi/alcalosi metabolica) e respirazione esterna (acidosi/alcalosi gassosa). Nei casi più gravi, il pH può essere normalizzato introducendo soluzioni tampone nella vittima.
3. Legame e inattivazione degli elementi strutturali del fluido intercellulare e del plasma sanguigno. Il plasma sanguigno contiene elementi strutturali con elevata attività biologica che possono diventare bersaglio di sostanze tossiche. Questi includono, ad esempio, fattori del sistema di coagulazione del sangue, enzimi idrolitici (esterasi) che distruggono gli xenobiotici, ecc. La conseguenza di tale azione può essere non solo l'intossicazione, ma anche l'allobiosi. Ad esempio, l'inibizione dell'attività delle carbossilesterasi del plasma sanguigno da parte del tri-o-cresil fosfato (TOCP), che distrugge i composti organofosforici (OP), porta ad un aumento significativo della tossicità di questi ultimi.
4. Violazione pressione osmotica. Violazioni significative della pressione osmotica del sangue e del liquido interstiziale durante l'intossicazione, di regola, sono di natura secondaria (funzioni compromesse del fegato, dei reni, edema polmonare tossico). L'effetto di sviluppo influisce negativamente sullo stato funzionale di cellule, organi e tessuti dell'intero organismo.
3. Azione delle sostanze tossiche sugli elementi strutturali delle cellule
Gli elementi strutturali delle cellule con cui interagiscono le sostanze tossiche, di regola, sono:
Elementi lipidici delle biomembrane;
Recettori selettivi per bioregolatori endogeni (ormoni, neurotrasmettitori, ecc.).
TOSSICOMETRIA
DIPENDENZA “DOSE-EFFETTO” IN TOSSICOLOGIA
Lo spettro delle manifestazioni del processo tossico è determinato dalla struttura della sostanza tossica. Tuttavia, la gravità dell'effetto di sviluppo dipende dalla quantità di agente attivo.
Per denotare la quantità di una sostanza che agisce su un oggetto biologico, viene utilizzato il concetto di dose. Ad esempio, l'introduzione di una sostanza tossica nella quantità di 500 mg nello stomaco di un ratto del peso di 250 g e di un coniglio del peso di 2000 g significa che gli animali hanno ricevuto dosi pari rispettivamente a 2 e 0,25 mg/kg (il concetto di " dose" sarà discusso più dettagliatamente di seguito).
La dipendenza “dose-effetto” può essere rintracciata a tutti i livelli dell'organizzazione della materia vivente: da quello molecolare a quello della popolazione. In questo caso, nella stragrande maggioranza dei casi, si registrerà uno schema generale: con l'aumento della dose aumenta il grado di danno al sistema; un numero crescente dei suoi elementi costitutivi sono coinvolti nel processo.
A seconda della dose efficace, quasi tutte le sostanze in determinate condizioni possono essere dannose per l'organismo. Questo è vero per le sostanze tossiche che agiscono sia localmente che dopo il riassorbimento ambienti interni.
La manifestazione della dipendenza "dose-effetto" è significativamente influenzata dalla variabilità intra e interspecifica degli organismi. Infatti, gli individui appartenenti alla stessa specie differiscono significativamente tra loro in termini biochimici, fisiologici, caratteristiche morfologiche. Queste differenze sono nella maggior parte dei casi dovute alle loro caratteristiche genetiche. Ancora più pronunciate, a causa delle stesse caratteristiche genetiche, le differenze interspecie. A questo proposito, le dosi di una particolare sostanza in cui essa provoca danni agli organismi della stessa e, inoltre, tipi diversi talvolta differiscono in modo significativo. Di conseguenza, la dipendenza "dose-effetto" riflette le proprietà non solo della sostanza tossica, ma anche dell'organismo su cui agisce. In pratica, ciò significa che in un esperimento su vari oggetti biologici dovrebbe essere effettuata una valutazione quantitativa della tossicità basata sullo studio della relazione dose-effetto, ed è imperativo ricorrere a metodi statistici elaborazione dei dati ricevuti.
Relazione dose-effetto in termini di letalità
4.1.3.1. Rappresentazioni generali
Poiché la morte dopo l'azione di una sostanza tossica è una reazione alternativa che si realizza secondo il principio "tutto o niente", questo effetto è considerato il più conveniente per determinare la tossicità delle sostanze, viene utilizzato per determinare il valore del letale medio dose (LD50).
La definizione di tossicità acuta in termini di "letalità" viene effettuata mediante il metodo della formazione di sottogruppi (vedi sopra). L'introduzione di una sostanza tossica viene effettuata da uno di modi possibili(enterale, parenterale) in condizioni controllate. Va tenuto presente che il metodo di somministrazione della sostanza influisce in modo più significativo sull'entità della tossicità.
Vengono utilizzati animali dello stesso sesso, età, peso, tenuti con una determinata dieta condizioni necessarie posizionamento, temperatura, umidità, ecc. Gli studi vengono ripetuti su diversi tipi di animali da laboratorio. Dopo la somministrazione del composto chimico in esame, vengono effettuate osservazioni per determinare il numero di animali morti, generalmente in un periodo di 14 giorni. Nel caso di applicazione di una sostanza sulla pelle, è assolutamente necessario registrare il tempo di contatto, nonché specificare le condizioni di applicazione (da uno spazio chiuso o aperto, l'esposizione è stata effettuata). Ovviamente, l'entità del danno cutaneo e la gravità dell'effetto di riassorbimento dipendono sia dalla quantità di materiale applicato che dalla durata del suo contatto con la pelle. Per tutte le modalità di esposizione diverse dall'inalazione, la dose di esposizione è solitamente espressa come massa (o volume) della sostanza in esame per unità di massa corporea (mg/kg; ml/kg).
Per l'esposizione per inalazione, la dose di esposizione è espressa come la quantità di sostanza in esame presente in un'unità di volume d'aria: mg/m3 o parti per milione (ppm - parti per milione). Con questo metodo di esposizione è molto importante considerare il tempo di esposizione. Più lunga è l'esposizione, maggiore è la dose di esposizione, maggiore è il potenziale di effetti avversi. Le informazioni ottenute sulla relazione dose-risposta per diverse concentrazioni della sostanza nell'aria inalata dovrebbero essere ottenute allo stesso tempo di esposizione. L'esperimento può essere costruito in un altro modo, vale a dire vari gruppi gli animali da esperimento hanno inalato la sostanza alla stessa concentrazione, ma per tempi diversi.
Per una valutazione approssimativa della tossicità delle sostanze attive inalate, che tenga conto contemporaneamente sia della concentrazione della sostanza tossica che del tempo della sua esposizione, è consuetudine utilizzare il valore di “toxodose” calcolato secondo la formula proposta da Haber al inizio secolo:
W = C t , dove
W - tossodose (mg min/m3)
С - concentrazione della sostanza tossica (mg/m3)
t - tempo di esposizione (min)
Si presuppone che con l'inalazione di sostanze a breve termine, lo stesso effetto (morte di animali da laboratorio) si otterrà sia con una breve esposizione a dosi elevate che con un'esposizione più lunga a sostanze a concentrazioni inferiori, mentre il prodotto a concentrazione temporale per il la sostanza rimane invariata. Molto spesso, la definizione di toxodosi delle sostanze veniva utilizzata per caratterizzare gli agenti di guerra chimica.
Interpretazione e utilizzo pratico dei risultati
Di norma, la conclusione principale che il tossicologo trae quando stabilisce una relazione dose-effetto positiva è che esiste una relazione causale tra l'esposizione alla sostanza in esame e lo sviluppo del processo tossico. Tuttavia, le informazioni sulle dipendenze dovrebbero essere interpretate solo in relazione alle condizioni in cui sono state ottenute. Un gran numero di fattori influenzano il suo carattere, ed è specifico per ciascuna sostanza e specie biologica, sui rappresentanti delle quali agisce la sostanza. A questo proposito bisogna tenere conto di una serie di fattori:
1. L'accuratezza delle caratteristiche quantitative del valore LD50 è ottenuta attraverso un'attenta sperimentazione e un'adeguata elaborazione statistica dei risultati. Se, ripetendo l'esperimento per determinare la tossicità, si ottengono dati quantitativi diversi da quelli ottenuti in precedenza, ciò può essere dovuto alla variabilità delle proprietà dell'oggetto biologico utilizzato e delle condizioni ambientali.
2. La caratteristica più importante della pericolosità di una sostanza è il momento della morte dopo l'esposizione alla sostanza tossica. Quindi, sostanze lo stesso valore LD50, ma tempi differenti la morte può comportare una serie di rischi. Veloce ingredienti attivi spesso considerato più pericoloso. Tuttavia, le sostanze "ritardate" con un periodo di latenza molto lungo tendono spesso ad accumularsi nell'organismo e sono quindi anche estremamente pericolose. Le sostanze tossiche ad azione rapida includono agenti di guerra chimica (FOV, acido cianidrico, irritanti, ecc.). Le sostanze ritardanti sono idrocarburi policiclici polialogenati (diossine alogenate, dibenzofurani, ecc.), alcuni metalli (cadmio, tallio, mercurio, ecc.) e molti altri.
3. Un'interpretazione più completa dei risultati ottenuti sulla valutazione della tossicità, oltre alla determinazione delle caratteristiche quantitative, richiede uno studio dettagliato delle cause di morte (vedere la sezione pertinente). Se una sostanza può provocare diversi effetti potenzialmente letali (arresto respiratorio, arresto cardiaco, collasso, ecc.), è necessario capire quale degli effetti è il principale, e anche se questo fenomeno può causare una complicazione del rapporto dose-risposta relazione. Ad esempio, diversi effetti biologici possono causare la morte nelle fasi acute e ritardate dell'intossicazione. Pertanto, l'intossicazione con dicloroetano può portare alla morte di un animale da esperimento già nelle prime ore a causa della depressione del sistema nervoso centrale (effetto narcotico, non elettrolitico). Negli ultimi periodi di intossicazione, l'animale muore per malattie renali acute e insufficienza epatica(effetto citotossico). Ovviamente questo è importante anche per determinare le caratteristiche quantitative della tossicità. Pertanto, il nitrito di terz-butile, quando somministrato per via intraperitoneale ai topi e registrando un effetto letale entro 30 minuti, ha un valore di LD50 di 613 mg/kg; quando si registrano decessi entro 7 giorni, LD50 è 187 mg/kg. La morte nei primi minuti, a quanto pare, avviene a causa di un indebolimento del tono vascolare e della formazione di metaemoglobina, nel periodo tardivo, a causa di un danno epatico.
4. Il valore LD50 ottenuto in un esperimento acuto non è una caratteristica della tossicità di una sostanza durante la sua esposizione subacuta o cronica ripetuta. Pertanto, per le sostanze con elevata capacità di accumulo, il valore della concentrazione letale di una sostanza tossica nell'ambiente, determinata dopo una singola iniezione, può essere significativamente superiore alla concentrazione che provoca la morte durante un'esposizione prolungata. Per le sostanze debolmente cumulative, queste differenze potrebbero non essere così significative.
In pratica, i dati dose-risposta e i valori LD50 vengono spesso utilizzati nelle seguenti situazioni:
1. Caratterizzare la tossicità acuta delle sostanze durante studi tossicologici di routine e confrontare la tossicità di diversi composti chimici.
TOSSICOCINETICA
La tossicocinetica è una sezione della tossicologia che studia i modelli, nonché le caratteristiche qualitative e quantitative di riassorbimento, distribuzione, biotrasformazione degli xenobiotici nel corpo e loro eliminazione (Figura 1).
Figura 1. Fasi di interazione tra un organismo e uno xenobiotico
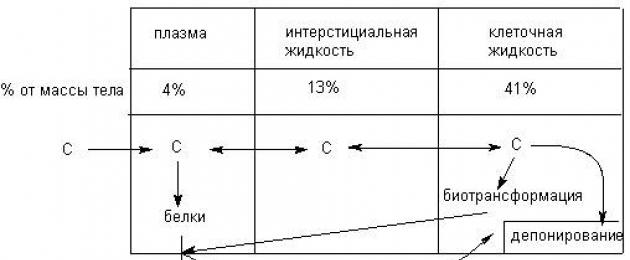
Dal punto di vista tossicocinetico, il corpo è un sistema eterogeneo complesso costituito da un gran numero di compartimenti (sezioni): sangue, tessuti, fluido extracellulare, contenuto intracellulare, con proprietà diverse, separati tra loro da barriere biologiche. Le barriere comprendono le membrane cellulari e intracellulari, le barriere istoematiche (ad esempio, il sangue cerebrale), i tessuti tegumentari (pelle, mucose). La cinetica delle sostanze nell'organismo è, infatti, il loro superamento delle barriere biologiche e la distribuzione tra i compartimenti (Figura 2).
Nel corso della ricezione, distribuzione, rimozione di una sostanza, vengono eseguiti i processi di miscelazione (convezione), dissoluzione in mezzi biologici, diffusione, osmosi e filtrazione attraverso barriere biologiche.
Le caratteristiche specifiche della tossicocinetica sono determinate sia dalle proprietà della sostanza stessa che dalle caratteristiche strutturali e funzionali dell'organismo.

Figura 2. Schema del movimento delle sostanze nei principali compartimenti del corpo
Le caratteristiche più importanti di una sostanza che influenzano i suoi parametri tossicocinetici sono:
Il coefficiente di distribuzione nel sistema olio/acqua - determina la capacità di accumularsi nell'ambiente appropriato: liposolubile - nei lipidi; solubile in acqua - in acqua;
Dimensione della molecola: influenza la capacità di diffondersi nell'ambiente e penetrare attraverso i pori delle membrane e delle barriere biologiche;
Costante di dissociazione: determina la parte relativa delle molecole tossiche che si sono dissociate nelle condizioni dell'ambiente interno del corpo, ad es. il rapporto tra molecole in forma ionizzata e non ionizzata. Le molecole dissociate (ioni) penetrano scarsamente nei canali ionici e non penetrano le barriere lipidiche;
Proprietà chimiche: determinano l'affinità della sostanza tossica con gli elementi chimici e biochimici di cellule, tessuti e organi.
Proprietà dell'organismo che influenzano la tossicocinetica degli xenobiotici.
Proprietà del compartimento:
Il rapporto tra acqua e grasso nelle cellule, nei tessuti e negli organi. Le strutture biologiche possono contenere poco (tessuto muscolare) o molto grasso (membrane biologiche, tessuto adiposo, cervello);
La presenza di molecole che legano attivamente la sostanza tossica. Ad esempio, nelle ossa ci sono strutture che legano attivamente non solo il calcio, ma anche altri metalli bivalenti (piombo, stronzio, ecc.).
Proprietà delle barriere biologiche:
Spessore;
La presenza e la dimensione dei pori;
Presenza o assenza di meccanismi per il trasporto attivo o facilitato di sostanze chimiche.
Secondo le idee esistenti, la forza dell'azione di una sostanza sul corpo è una funzione della sua concentrazione nel sito di interazione con la struttura bersaglio, che a sua volta è determinata non solo dalla dose, ma anche dai parametri tossicocinetici di lo xenobiotico. La tossicocinetica formula la risposta alla domanda: in che modo la dose e il metodo di azione di una sostanza sul corpo influenzano lo sviluppo del processo tossico?
METABOLISMO DEGLI XENOBIOTI
Molti xenobiotici, una volta nell'organismo, subiscono biotrasformazione e vengono escreti come metaboliti. La biotrasformazione si basa principalmente su trasformazioni enzimatiche di molecole. Il significato biologico del fenomeno è la trasformazione di una sostanza chimica in una forma conveniente per l'escrezione dal corpo, riducendo così il tempo della sua azione.
Il metabolismo degli xenobiotici avviene in due fasi (Figura 1).

Figura 1. Fasi del metabolismo dei composti estranei
Durante la prima fase della trasformazione redox o idrolitica, la molecola della sostanza si arricchisce di gruppi funzionali polari, che la rendono reattiva e più solubile in acqua. Nella seconda fase avvengono processi sintetici di coniugazione degli intermedi metabolici con molecole endogene, che portano alla formazione di composti polari che vengono escreti dall'organismo mediante particolari meccanismi di escrezione.
La varietà di proprietà catalitiche degli enzimi di biotrasformazione e la loro bassa specificità di substrato consentono all'organismo di metabolizzare le sostanze del struttura diversa. Allo stesso tempo, negli animali di specie diverse e nell'uomo, il metabolismo degli xenobiotici è lungi dall'essere lo stesso, poiché gli enzimi coinvolti nella trasformazione delle sostanze estranee sono spesso specie-specifici.
La modificazione chimica della molecola xenobiotica può comportare:
1. Attenuazione della tossicità;
2. Aumento della tossicità;
3. Cambiare la natura dell'effetto tossico;
4. Inizio del processo tossico.
Il metabolismo di molti xenobiotici è accompagnato dalla formazione di prodotti che hanno una tossicità significativamente inferiore alle sostanze originali. Pertanto, i tiocianati formati durante la bioconversione dei cianuri sono diverse centinaia di volte meno tossici degli xenobiotici originali. La scissione idrolitica dello ione fluoro dalle molecole di sarin, soman, diisopropilfluorofosfato porta alla perdita della capacità di queste sostanze di inibire l'attività dell'acetilcolinesterasi e ad una significativa diminuzione della loro tossicità. Il processo di perdita di tossicità da parte di una sostanza tossica a seguito della biotrasformazione viene definito "disintossicazione metabolica".
FONDAMENTI DI ECOTOSSICOLOGIA
Lo sviluppo dell'industria è indissolubilmente legato all'ampliamento della gamma dei prodotti chimici utilizzati. Maggiore utilizzo di pesticidi, fertilizzanti e altri prodotti chimici - caratteristica agricoltura e silvicoltura moderne. Questa è la ragione oggettiva del costante aumento del pericolo chimico per l’ambiente, nascosto nella natura stessa dell’attività umana.
Alcuni decenni fa, i rifiuti della produzione chimica venivano semplicemente scaricati nell’ambiente, e pesticidi e fertilizzanti venivano spruzzati in modo quasi incontrollabile, sulla base di considerazioni utilitaristiche, su vasti territori. Allo stesso tempo, si credeva che le sostanze gassose dovessero dissiparsi rapidamente nell'atmosfera, i liquidi dovessero dissolversi parzialmente nell'acqua ed essere portati via dai luoghi di rilascio. E sebbene i prodotti solidi fossero in gran parte accumulati nelle regioni, il pericolo potenziale delle emissioni industriali è stato considerato basso. L’uso di pesticidi e fertilizzanti ha avuto un effetto economico molte volte maggiore del danno causato dalle sostanze tossiche alla natura.
Tuttavia, già nel 1962 apparve il libro Silent Spring di Rachel Carson, in cui l'autore descrive casi di morte di massa di uccelli e pesci a causa dell'uso incontrollato di pesticidi. Carson ha concluso che gli effetti osservati degli inquinanti sulla fauna selvatica fanno presagire un disastro imminente anche per gli esseri umani. Questo libro ha attirato l'attenzione di tutti. Sono apparse società per la protezione dell'ambiente e una legislazione governativa che regola il rilascio di xenobiotici. Questo libro, infatti, ha dato inizio allo sviluppo di una nuova branca della scienza: la tossicologia.
L'ecotossicologia fu individuata come scienza indipendente da Rene Trout, che per la prima volta, nel 1969, collegò insieme due materie completamente diverse: l'ecologia (secondo Krebs, la scienza delle relazioni che determinano la distribuzione e l'abitazione degli esseri viventi) e la tossicologia. . Infatti, questo campo della conoscenza comprende, oltre a quelli indicati, elementi di altre scienze naturali, come la chimica, la biochimica, la fisiologia, la genetica delle popolazioni, ecc.
Con il progredire dello sviluppo, il concetto stesso di Uecotossicologia ha subito una certa evoluzione. Nel 1978 Butler considerava l'ecotossicologia una scienza che studia gli effetti tossici degli agenti chimici sugli organismi viventi, soprattutto a livello di popolazioni e comunità, all'interno di determinati ecosistemi. Levine e colleghi la definirono nel 1989 come la scienza che prevede la previsione degli effetti delle sostanze chimiche sugli ecosistemi. Nel 1994, W. e T. Forbes hanno dato la seguente definizione di ecotossicologia: Un campo della conoscenza che riassume gli effetti ambientali e tossicologici degli inquinanti chimici su popolazioni, comunità ed ecosistemi, tracciando il destino (trasporto, trasformazione e rimozione) di tali inquinanti nell'ambiente.
Pertanto, l'ecotossicologia, secondo gli autori, studia lo sviluppo di effetti avversi che si manifestano sotto l'azione degli inquinanti su un'ampia varietà di organismi viventi (dai microrganismi agli esseri umani), di regola, a livello di popolazioni o ecosistemi come nel suo insieme, così come il destino di una sostanza chimica in un sistema biogeocenosi.
Successivamente, nel quadro dell'ecotossicologia, iniziarono a individuare, come direzione indipendente, una delle sue sezioni, chiamata Utossicologia dell'ambiente (tossicologia ambientale).
C'è stata la tendenza a usare il termine Uecotossicologia solo per riferirsi all'insieme delle conoscenze riguardanti gli effetti delle sostanze chimiche sugli ecosistemi, escluso l'uomo. Pertanto, secondo Walker e colleghi (1996), l'ecotossicologia è lo studio degli effetti dannosi delle sostanze chimiche sugli ecosistemi. Eliminando gli oggetti umani dalla cerchia degli oggetti considerati dall'ecotossicologia, questa definizione determina la differenza tra ecotossicologia e tossicologia ambientale, determina l'oggetto di studio di quest'ultima. Si propone di utilizzare il termine Utossicologia ambientale solo per studi sugli effetti diretti degli inquinanti ambientali sull'uomo.
Nel processo di studio degli effetti delle sostanze chimiche presenti nell'ambiente sugli esseri umani e sulle comunità umane, la tossicologia ambientale opera con le categorie e i concetti già stabiliti della tossicologia classica e, di regola, applica la sua tradizionale metodologia sperimentale, clinica ed epidemiologica. L'oggetto della ricerca sono i meccanismi, le dinamiche di sviluppo, le manifestazioni degli effetti avversi delle sostanze tossiche e i prodotti della loro trasformazione nell'ambiente sull'uomo.
Condividendo in generale questo approccio e valutandone positivamente la portata pratica, va notato, tuttavia, che le differenze metodologiche tra ecotossicologia e tossicologia ambientale vengono completamente cancellate quando il ricercatore è incaricato di valutare gli effetti indiretti degli inquinanti sulle popolazioni umane (ad esempio, a causa della modificazione tossica del biota) o, al contrario, per scoprire i meccanismi d'azione delle sostanze chimiche nell'ambiente sui rappresentanti di una particolare specie di esseri viventi. A questo proposito, dal punto di vista teorico, l'Uetossicologia dell'ambiente, come scienza, è solo un problema particolare dell'Uecotossicologia, mentre la metodologia, l'apparato concettuale e la struttura delle scienze sono le stesse.
1. Profilo xenobiotico dell'ambiente
Dal punto di vista di un tossicologo, gli elementi abiotici e biotici di quello che chiamiamo ambiente sono tutti complessi, talvolta organizzati in modo speciale, agglomerati, miscele di innumerevoli molecole.
Per l’ecotossicologia sono interessanti solo le molecole con biodisponibilità, cioè in grado di interagire in modo non meccanico con gli organismi viventi. Di norma, si tratta di composti che si trovano in forma gassosa o stato liquido, sotto forma di soluzioni acquose, adsorbite su particelle di terreno e superfici varie, solidi, ma sotto forma di polvere fine (dimensione delle particelle inferiore a 50 micron), ed infine sostanze che entrano nell'organismo con gli alimenti.
Alcuni dei composti biodisponibili vengono utilizzati dagli organismi, partecipando ai processi della loro plastica e metabolismo energetico con l'ambiente, ad es. fungere da risorsa per l’ambiente. Altri, entrando nell'organismo di animali e piante, non vengono utilizzati come fonti di energia o materiale plastico, ma, agendo in dosi e concentrazioni sufficienti, sono in grado di modificare significativamente il corso della normale processi fisiologici. Tali composti sono chiamati alieni o xenobiotici (estranei alla vita).
L'insieme delle sostanze estranee contenute nell'ambiente (acqua, suolo, aria e organismi viventi) in una forma (stato aggregato) che consente loro di entrare in interazioni chimiche e fisico-chimiche con oggetti biologici dell'ecosistema costituiscono il profilo xenobiotico della biogeocenosi . Il profilo xenobiotico dovrebbe essere considerato come uno dei fattori ambientali più importanti (insieme a temperatura, illuminazione, umidità, condizioni trofiche, ecc.), che può essere descritto da caratteristiche qualitative e quantitative.
Un elemento importante del profilo xenobiotico sono le sostanze estranee contenute negli organi e nei tessuti degli esseri viventi, poiché prima o poi vengono tutte consumate da altri organismi (cioè hanno biodisponibilità). Al contrario, le sostanze chimiche fissate negli oggetti solidi, non disperdibili nell'aria e insolubili nell'acqua (rocce, prodotti industriali solidi, vetro, plastica, ecc.) non hanno biodisponibilità. Possono essere considerati fonti di formazione del profilo xenobiotico.
I profili xenobiotici dell'ambiente, formati nel corso dei processi evolutivi avvenuti sul pianeta per milioni di anni, possono essere chiamati profili xenobiotici naturali. Sono diversi nelle diverse regioni della Terra. Le biocenosi esistenti in queste regioni (biotopi) sono in una certa misura adattate ai corrispondenti profili xenobiotici naturali.
Varie collisioni naturali, e in l'anno scorso e l’attività economica umana, a volte modificano in modo significativo il profilo xenobiotico naturale di molte regioni (soprattutto quelle urbanizzate). Le sostanze chimiche che si accumulano nell'ambiente in quantità insolite e causano cambiamenti nel profilo xenobiotico naturale agiscono come ecoinquinanti (inquinanti). Un cambiamento nel profilo xenobiotico può derivare da un eccessivo accumulo di uno o più ecoinquinanti nell’ambiente.
Ciò non sempre porta a conseguenze dannose per la fauna selvatica e la popolazione. Solo un ecoinquinante accumulato nell'ambiente in quantità sufficiente ad avviare un processo tossico in una biocenosi (a qualsiasi livello di organizzazione della materia vivente) può essere designato come ecotossico.
Uno dei compiti pratici più difficili dell'ecotossicologia è determinare i parametri quantitativi ai quali un ecoinquinante si trasforma in un ecotossico. Nel risolverlo è necessario tenere conto che, in condizioni reali, l'intero profilo xenobiotico dell'ambiente agisce sulla biocenosi, modificando l'attività biologica di un singolo inquinante. Pertanto, nelle diverse regioni (diversi profili xenobiotici, diverse biocenosi), i parametri quantitativi della trasformazione di un inquinante in un ecotossico sono in senso stretto diversi.
2. Ecotossicocinetica
Ecotossicocinetica - una sezione dell'ecotossicologia che considera il destino degli xenobiotici (ecoinquinanti) nell'ambiente: le fonti della loro comparsa; distribuzione negli elementi abiotici e biotici dell'ambiente; trasformazione xenobiotica nell'ambiente; eliminazione dall'ambiente.
2.1. Formazione del profilo xenobiotico. Fonti di inquinanti immessi nell'ambiente
Le fonti naturali di xenobiotici biodisponibili, secondo l'OMS (1992), includono: particelle di polvere portate dal vento, aerosol di sale marino, attività vulcanica, incendi boschivi, particelle biogeniche, sostanze volatili biogeniche. Un'altra fonte di xenobiotici nell'ambiente, la cui importanza è in costante aumento, è l'attività umana.
L'elemento più importante della caratterizzazione ecotossicologica degli inquinanti è l'identificazione delle loro fonti. Risolvere questo problema è tutt'altro che facile, perché a volte la sostanza entra nell'ambiente in quantità trascurabili, a volte sotto forma di impurità fino a sostanze del tutto innocue. Infine, la formazione di un ecoinquinante nell'ambiente è possibile a seguito di trasformazioni abiotiche o biotiche di altre sostanze.
2.2. persistenza
Numerosi processi abiotici (che si verificano senza la partecipazione di organismi viventi) e biotici (che si verificano con la partecipazione di organismi viventi) nell'ambiente mirano all'eliminazione (rimozione) degli ecoinquinanti. Molti xenobiotici, penetrati nell'aria, nel suolo, nell'acqua, causano danni minimi agli ecosistemi, poiché il tempo della loro esposizione è trascurabile. Le sostanze resistenti ai processi di degrado e, di conseguenza, persistenti nell'ambiente per lungo tempo, di norma sono ecotossiche potenzialmente pericolose.
Il costante rilascio di inquinanti persistenti nell'ambiente porta al loro accumulo e trasformazione in ecotossici per la parte più vulnerabile (sensibile) del biosistema. Dopo che il rilascio di una sostanza tossica persistente è cessato, è immobile a lungo immagazzinato nell'ambiente. Così, negli anni '90, nelle acque del lago Ontario furono determinate elevate concentrazioni del pesticida mirex, il cui utilizzo fu interrotto alla fine degli anni '70. Nei corpi idrici del sito di test dell'aeronautica americana in Florida, dove l'Agente Orange fu spruzzato per scopi di ricerca nel 1962-1964, 10 anni dopo i fanghi contenevano 10-35 ng/kg TCDD (normalmente, secondo gli standard statunitensi - 0,1 conf./kg, Russia - 10 conf./kg).
Tra le sostanze che persistono a lungo nell'ambiente figurano i metalli pesanti (piombo, rame, zinco, nichel, cadmio, cobalto, antimonio, mercurio, arsenico, cromo), idrocarburi policiclici polialogenati (policlorodibenzodiossine e dibenzofurani, policlorobifenili, ecc.). ), alcuni pesticidi organoclorurati (DDT, esaclorano, aldrin, lindano, ecc.) e molte altre sostanze.
2.3. Trasformazione
La stragrande maggioranza delle sostanze subisce varie trasformazioni nell'ambiente. La natura e la velocità di queste trasformazioni ne determinano la durabilità.
2.3.1. Trasformazione abiotica
Numerosi processi influenzano la persistenza di una sostanza nell'ambiente. I principali sono la fotolisi (distruzione sotto l'influenza della luce), l'idrolisi, l'ossidazione.
Fotolisi. leggero, soprattutto raggi ultravioletti, capace di distruggere legami chimici e quindi causare la degradazione delle sostanze chimiche. La fotolisi avviene principalmente nell'atmosfera e sulla superficie del suolo e dell'acqua. La velocità della fotolisi dipende dall'intensità della luce e dalla capacità della sostanza di assorbirla. I composti aromatici insaturi, come gli idrocarburi policiclici aromatici (IPA), sono i più sensibili alla fotolisi, perché assorbire attivamente l'energia luminosa. La luce accelera altri processi di degradazione delle sostanze: idrolisi e ossidazione. A sua volta, la presenza di fotoossidanti nei mezzi, come ozono, ossidi di azoto, formaldeide, acroleina, perossidi organici, accelera significativamente il processo di fotolisi di altri inquinanti (mostrato per gli IPA).
Idrolisi. L'acqua, soprattutto se riscaldata, distrugge rapidamente molte sostanze. I legami eterei, ad esempio, nelle molecole dei composti organofosforici, sono altamente sensibili all'azione dell'acqua, che determina la moderata stabilità di questi composti nell'ambiente. La velocità di idrolisi dipende fortemente dal pH. Come risultato della trasformazione delle sostanze chimiche nell'ambiente, si formano nuove sostanze. Tuttavia, la loro tossicità può talvolta essere superiore a quella dell’agente progenitore.
Trasformazione biotica
La degradazione abiotica delle sostanze chimiche solitamente procede a un ritmo lento. Gli xenobiotici si degradano molto più velocemente con la partecipazione del biota, in particolare dei microrganismi (principalmente batteri e funghi), che li utilizzano come nutrienti. Il processo di distruzione biotica avviene con la partecipazione di enzimi. Le biotrasformazioni delle sostanze si basano sui processi di ossidazione, idrolisi, dealogenazione, scissione delle strutture cicliche della molecola, eliminazione dei radicali alchilici (dealchilazione), ecc. La degradazione di un composto può concludersi con la sua completa distruzione, ovvero mineralizzazione (formazione di acqua, anidride carbonica, altri composti semplici). Tuttavia è possibile che si formino prodotti intermedi della biotrasformazione di sostanze che talvolta presentano una tossicità maggiore rispetto all'agente originario. Pertanto, la conversione dei composti inorganici del mercurio da parte del fitoplancton può portare alla formazione di composti organomercurici più tossici, in particolare il metilmercurio. Un fenomeno simile si è verificato in Giappone, sulle rive della baia di Minamato, negli anni '50 e '60. Il mercurio che entrava nelle acque della baia con gli effluenti dell'impianto per la produzione di composti azotati veniva trasformato dal biota in metilmercurio. Quest'ultimo era concentrato nei tessuti degli organismi marini e dei pesci, che servivano da cibo alla popolazione locale. Di conseguenza, le persone che consumavano pesce hanno sviluppato una malattia caratterizzata da un complesso complesso di sintomi neurologici e sono state osservate malformazioni nei neonati. In totale sono stati registrati 292 casi di malattia di Minamato, 62 dei quali si sono conclusi con la morte.
2.4. Processi di eliminazione non associati alla distruzione
Alcuni processi che si verificano nell'ambiente contribuiscono all'eliminazione degli xenobiotici dalla regione, modificandone la distribuzione nei componenti dell'ambiente. Un inquinante con un elevato valore di pressione di vapore può facilmente evaporare dall'acqua e dal suolo, per poi spostarsi in altre regioni con la corrente d'aria. Questo fenomeno è alla base dell’ubiquità degli insetticidi organoclorurati relativamente volatili come il lindano e l’esaclorobenzene.
Anche la circolazione delle particelle di sostanze tossiche o del suolo su cui vengono assorbite sostanze dal vento e dalle correnti atmosferiche costituisce un'importante modalità di ridistribuzione degli inquinanti nell'ambiente. Tipico a questo riguardo è l'esempio degli idrocarburi policiclici aromatici (benzpireni, dibenzpireni, benzantraceni, dibenzantraceni, ecc.). Il benzpirene e i relativi composti sia di origine naturale (principalmente vulcanica) che antropica (emissioni da industrie metallurgiche, di raffinazione del petrolio, centrali termiche, ecc.) sono attivamente inclusi nel ciclo biosferico delle sostanze, spostandosi da un ambiente all'altro. In questo caso, di regola, sono associati a particelle solide di polvere atmosferica. La polvere fine (1-10 micron) rimane a lungo nell'aria, le particelle di polvere più grandi si depositano piuttosto rapidamente sul terreno e nell'acqua nel luogo di formazione. Le ceneri delle eruzioni vulcaniche contengono grandi quantità di queste sostanze. Allo stesso tempo, maggiore è l’emissione, maggiore è la distanza di dispersione degli inquinanti.
L'assorbimento delle sostanze sulle particelle sospese nell'acqua, seguito dalla sedimentazione, porta alla loro eliminazione dalla colonna d'acqua, ma all'accumulo nei sedimenti del fondo. Le precipitazioni riducono drasticamente la biodisponibilità del contaminante.
La ridistribuzione delle sostanze idrosolubili è facilitata dalle piogge e dal movimento delle falde acquifere. Ad esempio, l’erbicida atrazina, utilizzato per proteggere le piante a foglia larga nell’agricoltura e nei parchi negli Stati Uniti, è onnipresente negli Stati Uniti. acque superficiali. Secondo alcuni rapporti, fino al 92% dei corpi idrici esaminati negli Stati Uniti contengono questo pesticida. Poiché la sostanza è abbastanza stabile e facilmente solubile in acqua, migra nelle acque sotterranee e vi si accumula.
2.5. Bioaccumulo
Se l'inquinante ambientale non può entrare nel corpo, di solito non rappresenta un pericolo significativo per lo stesso. Tuttavia, una volta nell'ambiente interno, molti xenobiotici sono in grado di accumularsi nei tessuti (vedi sezione UTossicocinetica). Il processo mediante il quale gli organismi accumulano sostanze tossiche rimuovendole dalla fase abiotica (acqua, suolo, aria) e dagli alimenti (trasferimento trofico) è chiamato bioaccumulo. Il bioaccumulo comporta conseguenze dannose sia per l'organismo stesso (raggiungendo una concentrazione dannosa nei tessuti critici) sia per gli organismi che utilizzano questa specie biologica come cibo.
L'ambiente acquatico fornisce migliori condizioni per il bioaccumulo di composti. Miriadi vivono qui organismi acquatici, filtrando e attraversando un'enorme quantità di acqua, estraendo sostanze tossiche capaci di accumularsi. Gli idrobionti accumulano sostanze in concentrazioni talvolta migliaia di volte superiori a quelle contenute nell'acqua.
Fattori che influenzano il bioaccumulo
La propensione degli ecotossici al bioaccumulo dipende da una serie di fattori. Il primo è la persistenza dello xenobiotico nell’ambiente. Il grado di accumulo di una sostanza nel corpo è in definitiva determinato dal suo contenuto nell'ambiente. Le sostanze che vengono eliminate rapidamente generalmente non si accumulano bene nell'organismo. Fanno eccezione le condizioni in cui l'inquinante viene costantemente introdotto nell'ambiente (regioni vicine alle industrie, ecc.).
Pertanto l’acido cianidrico, pur essendo un composto tossico, a causa della sua elevata volatilità, non è, secondo molti esperti, un ecoinquinante potenzialmente pericoloso. È vero, finora non è stato possibile escludere completamente che alcuni tipi di malattie, disturbi della gravidanza nelle donne che vivono vicino a imprese di estrazione dell'oro, dove il cianuro viene utilizzato in grandi quantità, non siano associati all'effetto cronico della sostanza.
Dopo che le sostanze sono entrate nell'organismo, il loro destino è determinato da processi tossicocinetici (vedere la sezione pertinente). Le sostanze liposolubili (lipofile) che si metabolizzano lentamente nel corpo hanno la maggiore capacità di bioaccumulo. Il tessuto adiposo, di regola, è il luogo principale di deposizione a lungo termine di xenobiotici. Pertanto, molti anni dopo l’esposizione, sono stati riscontrati elevati livelli di TCDD in campioni bioptici di tessuto adiposo e plasma sanguigno di veterani dell’esercito americano, partecipanti guerra del Vietnam. Tuttavia, molte sostanze lipofile tendono ad adsorbire sulle superfici varie particelle depositate dall'acqua e dall'aria, il che riduce la loro biodisponibilità. Ad esempio, l’assorbimento del benzpirene da parte degli acidi umici riduce di un fattore tre la capacità della sostanza tossica di bioaccumularsi nei tessuti dei pesci. I pesci provenienti da corpi idrici con un basso contenuto di particelle sospese nell'acqua accumulano più DDT rispetto ai pesci provenienti da corpi idrici eutrofici con un alto contenuto di sostanze sospese.
Le sostanze che vengono metabolizzate nel corpo si accumulano in quantità minori di quanto ci si aspetterebbe in base alle loro proprietà fisico-chimiche. Le differenze interspecie nei valori dei fattori di bioaccumulo degli xenobiotici sono in gran parte determinate dalle caratteristiche della specie del loro metabolismo.
Importanza del bioaccumulo
Il bioaccumulo può essere alla base non solo di effetti tossici acuti cronici, ma anche ritardati. Pertanto, la rapida perdita di grasso, in cui è stata accumulata una grande quantità di sostanza, porta al rilascio di una sostanza tossica nel sangue. La mobilizzazione del tessuto adiposo negli animali viene spesso osservata durante la stagione riproduttiva. Nelle regioni ecologicamente sfavorevoli ciò può essere accompagnato dalla morte di massa di animali quando raggiungono la pubertà. Le sostanze inquinanti persistenti possono essere trasmesse anche alla prole, agli uccelli e ai pesci, insieme al contenuto sacco vitellino, nei mammiferi - con il latte di una madre che allatta. In questo caso, è possibile lo sviluppo di effetti nella prole che non si manifestano nei genitori.
2.6. Biomagnificazione
Le sostanze chimiche possono spostarsi attraverso le catene alimentari dagli organismi preda agli organismi consumatori. Per le sostanze altamente lipofile, questo movimento può essere accompagnato da un aumento della concentrazione della sostanza tossica nei tessuti di ciascun organismo successivo, un anello della catena alimentare. Questo fenomeno è chiamato biomagnificazione. Quindi, il DDT è stato utilizzato per uccidere le zanzare su uno dei laghi californiani. Dopo il trattamento, il contenuto di pesticidi nell'acqua era di 0,02 parti per milione (ppm). Dopo qualche tempo, la concentrazione del DDT fu determinata a 10 ppm nel plancton, 900 ppm nei tessuti dei pesci planctivori, 2700 ppm nei pesci predatori e 21000 ppm negli uccelli piscivori. Cioè, il contenuto di DDT nei tessuti degli uccelli che non erano stati direttamente esposti al pesticida era 1.000.000 di volte superiore a quello dell'acqua e 20 volte superiore a quello del corpo dei pesci, il primo anello della catena alimentare.
Il libro di Rachel Carson, Primavera silenziosa, menzionato in precedenza, fornisce un esempio del genere. Gli alberi sono stati trattati con DDT per controllare il vettore dell'alburno dell'olmo, Scolytes multistriatus, un vettore dell'alburno dell'olmo. Parte del pesticida è penetrata nel terreno, dove è stata assorbita dai lombrichi e accumulata nei tessuti. I tordi migratori che mangiano principalmente lombrichi hanno sviluppato avvelenamento da pesticidi. Alcuni di loro sono morti, mentre altri hanno avuto una funzione riproduttiva interrotta: hanno deposto uova sterili. Di conseguenza, il controllo delle malattie degli alberi ha portato alla quasi estinzione dei tordi migratori in diverse parti degli Stati Uniti.
3. Ecotossicodinamica
3.1. Concetti generali
L'ecotossicodinamica è una sezione dell'ecotossicologia che considera specifici meccanismi di sviluppo e forme del processo tossico causati dall'azione di ecotossici sulla biocenosi e/o sulle singole specie che la compongono.
I meccanismi attraverso i quali le sostanze possono causare effetti avversi nelle biogeocenosi sono numerosi e probabilmente unici in ogni caso. Sono comunque classificabili. Pertanto, è possibile individuare effetti diretti, indiretti e misti degli ecotossici.
L'azione diretta lo è sconfitta immediata organismi di una determinata popolazione o di più popolazioni (biocenosi) da un agente ecotossico o da una combinazione di ecotossici di un dato profilo xenobiotico dell'ambiente. Un esempio di sostanze con un meccanismo d'azione simile sull'uomo è il cadmio. Questo metallo si accumula nell'organismo anche al suo contenuto minimo nell'ambiente e, quando viene raggiunta una concentrazione critica, avvia un processo tossico che si manifesta con danni al sistema respiratorio, ai reni, immunosoppressione e cancerogenesi.
Indiretto: questa è l'azione del profilo xenobiotico dell'ambiente sugli elementi biotici o abiotici dell'habitat della popolazione, a seguito della quale le condizioni e le risorse dell'ambiente cessano di essere ottimali per la sua esistenza.
Molte sostanze tossiche sono in grado di esercitare sia effetti diretti che indiretti, vale a dire azione mista. Un esempio di sostanze con meccanismo misto di azione ecotossica sono, in particolare, gli erbicidi 2,4,5-T e 2,4-D, contenenti una piccola quantità di 2,3,7,8-tetraclorodibenzo-p-diossina ( TCDD) come impurità. L'uso diffuso di queste sostanze da parte dell'esercito americano in Vietnam ha causato danni significativi alla flora e alla fauna del paese e direttamente alla salute umana.
3.2. Ecotossicità
L’ecotossicità è la capacità di un dato profilo ambientale xenobiotico di provocare effetti avversi nella corrispondente biocenosi. In quei casi in cui la violazione del profilo xenobiotico naturale è associata all'eccessivo accumulo di un solo inquinante nell'ambiente, si può parlare condizionatamente dell'ecotossicità di solo questa sostanza.
In conformità con l'idea dei livelli di organizzazione dei sistemi biologici in ecologia, è consuetudine distinguere tre sezioni (G.V. Stadnitsky, A.I. Rodionov, 1996):
Autecologia: descrizione degli effetti ecologici a livello dell'organismo;
Demecologia: effetti ecologici a livello di popolazione;
Sinecologia - effetti a livello della biocenosi.
A questo proposito, ed effetti ecotossici avversi, è opportuno considerare:
A livello del corpo (autecotossico) - si manifestano con una diminuzione della resistenza ad altri fattori ambientali attivi, una diminuzione dell'attività, malattie, morte del corpo, carcinogenesi, disfunzione riproduttiva, ecc.
A livello di popolazione (demotossico) - si manifestano con la morte della popolazione, un aumento della morbilità, della mortalità, una diminuzione del tasso di natalità, un aumento del numero di difetti congeniti dello sviluppo, una violazione delle caratteristiche demografiche (il rapporto di età, sesso, ecc.), cambiamento dell’aspettativa di vita media, degrado culturale.
A livello di biogeocenosi (sinecotossica) - si manifestano con un cambiamento nello spettro della popolazione della cenosi, fino alla scomparsa di singole specie e alla comparsa di nuove che non sono caratteristiche di questa biocenosi, una violazione delle relazioni interspecifiche.
Nel caso di valutazione dell'ecotossicità di una sola sostanza rispetto a rappresentanti di una sola specie di esseri viventi, le caratteristiche qualitative e quantitative adottate nella tossicologia classica (valori di tossicità acuta, subacuta, cronica, dosi e concentrazioni che provocano effetti mutageni, cancerogeni e altri tipi di effetti, ecc.). Tuttavia, nei sistemi più complessi, l'ecotossicità non viene misurata con numeri (quantitativamente), ma è caratterizzata da una serie di indicatori qualitativi o semiquantitativi, attraverso i concetti di PericoloF o Rischio UecologicoF.
A seconda della durata dell'azione degli ecotossici sull'ecosistema si può parlare di ecotossicità acuta e cronica.
3.2.1. Ecotossicità acuta
L'effetto tossico acuto delle sostanze sulla biocenosi può essere il risultato di incidenti e catastrofi, accompagnati dal rilascio di grandi quantità di una sostanza tossica relativamente instabile nell'ambiente o dall'uso improprio di sostanze chimiche.
La storia conosce già tali eventi. Così, nel 1984, a Bhopal (India), si verificò un incidente nello stabilimento della società chimica americana per la produzione di pesticidi UUnion CarbideF. Di conseguenza, una grande quantità di sostanza polmonotropica metil isocianato è entrata nell'atmosfera. Essendo un liquido volatile, la sostanza formava un focolaio instabile di infezione. Tuttavia, circa 200mila persone furono avvelenate, di cui 3mila morirono. La principale causa di morte è l'edema polmonare acuto.
Un altro caso famoso In Iraq si è verificata una grave catastrofe tossico-ecologica. Il governo di questo stato ha acquistato una grande partita di grano come seme. Il grano da seme è stato trattato con fungicida al metilmercurio per il controllo dei parassiti. Tuttavia, questo lotto di grano arrivò accidentalmente sul mercato e fu utilizzato per cuocere il pane. Come risultato di questa catastrofe ecologica, furono avvelenate più di 6,5mila persone, di cui circa 500 morirono.
Nel 2000, in Romania, in una delle imprese per l'estrazione di metalli preziosi, a seguito di un incidente, sono fuoriusciti prodotti contenenti acido cianidrico e cianuro. Enormi quantità di sostanze tossiche sono entrate nelle acque del Danubio, avvelenando tutti gli esseri viventi per centinaia di chilometri a valle.
Il più grande disastro ambientale è l’uso di sostanze chimiche altamente tossiche per scopi militari. Durante la prima guerra mondiale, i paesi in guerra utilizzarono sui campi di battaglia circa 120mila tonnellate di sostanze velenose. Di conseguenza, più di 1,3 milioni di persone furono avvelenate, il che può essere considerato uno dei più grandi disastri ambientali nella storia dell’umanità.
L'effetto ecotossico acuto non porta sempre alla morte o Malattia acuta esseri umani o membri di altre specie che sono stati esposti. Quindi, tra gli agenti utilizzati nel primo guerra mondiale, c'era anche la mostarda di zolfo. Questa sostanza, essendo cancerogena, provocava la morte tardiva dei soggetti affetti da neoplasie.
3.2.2. Ecotossicità cronica
Gli effetti subletali sono solitamente associati alla tossicità cronica delle sostanze. Spesso ciò implica una violazione delle funzioni riproduttive, cambiamenti immunitari, patologia endocrina, malformazioni, allergie, ecc. Tuttavia, l’esposizione cronica a una sostanza tossica può anche portare alla morte tra gli individui di alcune specie.
Le manifestazioni dell'azione degli ecotossici sull'uomo possono essere molto diverse e, a certi livelli di intensità dell'esposizione, sono abbastanza specifiche per il fattore agente.
Meccanismi di ecotossicità
Nella letteratura moderna sono forniti numerosi esempi dei meccanismi d'azione delle sostanze chimiche sulla fauna selvatica, che consentono di valutarne la complessità e l'imprevisto.
1. Azione diretta delle sostanze tossiche, che porta alla morte di massa di specie sensibili. L'uso di pesticidi efficaci porta alla morte di massa di parassiti: insetti (insetticidi) o erbe infestanti (erbicidi). Questo effetto ecotossico costruisce una strategia per l’uso di sostanze chimiche. Tuttavia, in alcuni casi, si accompagnano fenomeni negativi. Quindi in Svezia, negli anni 50-60. il metilmercurio dicianammide è stato ampiamente utilizzato per il trattamento delle sementi delle colture di cereali. La concentrazione di mercurio nei cereali era superiore a 10 mg/kg. La beccata periodica del seme trattato da parte degli uccelli ha portato alla morte in massa di fagiani, piccioni, pernici e altri uccelli granivori provenienti da intossicazione cronica mercurio.
Quando si valuta la situazione ecologica, è necessario tenere presente la legge fondamentale della tossicologia: la sensibilità dei diversi tipi di organismi viventi alle sostanze chimiche è sempre diversa. Pertanto, la comparsa di un inquinante nell'ambiente, anche in piccole quantità, può essere dannosa per i rappresentanti delle specie più sensibili. Pertanto, il cloruro di piombo uccide la dafnia durante il giorno quando è contenuto nell'acqua ad una concentrazione di circa 0,01 mg / l, il che rappresenta un piccolo pericolo per i rappresentanti di altre specie.
2. Azione diretta dello xenobiotico, che porta allo sviluppo di condizioni allobiotiche e forme speciali del processo tossico. Alla fine degli anni ’80, circa 18.000 foche morirono a causa di infezioni virali nel Mar Baltico, nel Mare del Nord e nel Mare d’Irlanda. Nei tessuti degli animali morti è stato riscontrato un elevato contenuto di policlorobifenili (PCB). È noto che i PCB, come altri composti contenenti cloro, come DDT, esaclorobenzene, dieldrin, hanno un effetto immunosoppressivo sui mammiferi. Il loro accumulo nel corpo ha portato ad una diminuzione della resistenza delle foche alle infezioni. Pertanto, senza causare direttamente la morte degli animali, l'inquinante ha aumentato significativamente la loro sensibilità all'azione di altri fattori ambientali sfavorevoli.
Un classico esempio di questa forma di azione ecotossica è un aumento del numero di neoplasie, una diminuzione delle opportunità riproduttive nelle popolazioni di persone che vivono in regioni contaminate da ecotossici (territori del Vietnam del Sud - diossina).
3. Effetto embriotossico degli ecoinquinanti. È risaputo che il DDT, accumulandosi nei tessuti di uccelli come il germano reale, il falco pescatore, l'aquila calva, ecc., porta all'assottigliamento del guscio delle uova. Di conseguenza, i pulcini non possono nascere e muoiono. Ciò è accompagnato da una diminuzione della popolazione di uccelli.
Esempi degli effetti tossici di vari xenobiotici (inclusi medicinali) su embrioni umani e di mammiferi sono ampiamente conosciuti (vedi sezione Uteratogenesi).
4. Azione diretta del prodotto di biotrasformazione dell'inquinante con effetto insolito. Osservazioni sul campo di pesci vivi (ciprinidi) nello stato della Florida hanno rivelato popolazioni con un gran numero di femmine con segnali chiari mascolinizzazione (comportamento peculiare, modificazione della pinna anale, ecc.). Queste popolazioni sono state trovate in un fiume a valle di un impianto di lavorazione delle noci. Inizialmente si pensava che il deflusso contenesse sostanze mascolinizzanti. Tuttavia, gli studi hanno dimostrato che non sono presenti tali sostanze nelle emissioni: le acque reflue non hanno causato la mascolinizzazione. Inoltre, si è scoperto che le acque reflue contenevano fitosterone (formato durante la lavorazione delle materie prime), che, una volta nell'acqua del fiume, era esposto ai batteri che vivevano qui e con la loro partecipazione si trasformava in androgeni. Quest'ultimo ha causato anche un effetto negativo.
Ecotossicometria
Metodologia generale
L'ecotossicometria è una sezione dell'ecotossicologia, all'interno della quale vengono considerate tecniche metodologiche che consentono di valutare (prospettivamente o retrospettivamente) l'ecotossicità degli xenobiotici.
Tutti i tipi di studi tossicologici quantitativi classici sono pienamente utilizzati per determinare l'ecotossicità degli xenobiotici (vedere la sezione UTossicometria).
La tossicità acuta degli ecoinquinanti è determinata sperimentalmente su diverse specie rappresentative di vari livelli organizzazione trofica dell'ecosistema (alghe, piante, invertebrati, pesci, uccelli, mammiferi). L'Agenzia statunitense per la protezione dell'ambiente richiede, nel definire i criteri di qualità dell'acqua contenente una determinata sostanza tossica, di determinarne la tossicità su almeno 8 diversi tipi di organismi di acqua dolce e marini (16 test).
Sono stati fatti più volte tentativi per classificare le specie di esseri viventi in base alla loro sensibilità agli xenobiotici. Tuttavia, per varie sostanze tossiche, il rapporto tra la sensibilità degli esseri viventi nei loro confronti è diverso. Inoltre, l'uso in ecotossicologia della specie standard F da parte di rappresentanti di determinati livelli di organizzazione ecologica per determinare l'ecotossicità degli xenobiotici, da un punto di vista scientifico, non è corretto, poiché la sensibilità degli animali, anche delle specie vicine, a volte differisce in modo molto significativo .
Quando si valuta l'ecotossicità si deve tenere conto del fatto che, sebbene quasi tutte le sostanze possano causare effetti tossici acuti, non per tutti i composti viene rilevata una tossicità cronica. Un valore indiretto che indica il grado di pericolo di una sostanza durante la sua azione cronica è il rapporto tra le concentrazioni che causano effetti acuti (LC50) e cronici (soglia di azione tossica). Se questo rapporto è inferiore a 10, la sostanza è considerata a basso rischio di esposizione cronica.
Quando si valuta l'ecotossicità cronica di una sostanza, si dovrebbero tenere in considerazione le seguenti circostanze:
1. La determinazione del quoziente di rischio è solo il primo passo per determinare il potenziale ecotossico di una sostanza. In condizioni di laboratorio, le concentrazioni soglia dell'azione cronica delle sostanze tossiche vengono determinate valutando la mortalità, la crescita e le capacità riproduttive del gruppo. Lo studio di altri effetti dell'esposizione cronica a sostanze può talvolta portare a caratteristiche numeriche diverse.
2. Gli studi di tossicità vengono effettuati su animali idonei alla conservazione in condizioni di laboratorio. I risultati così ottenuti non possono essere considerati assoluti. Le sostanze tossiche possono causare effetti cronici in alcune specie e non in altre.
3. L'interazione di una sostanza tossica con elementi biotici e abiotici dell'ambiente può influenzare significativamente la sua tossicità in condizioni naturali (vedi sopra). Tuttavia, questo non è soggetto a studio sotto condizioni
Effetto tossico le sostanze nocive sono il risultato dell'interazione di un organismo, una sostanza nociva e l'ambiente. L'effetto dell'esposizione a varie sostanze dipende dalla quantità della sostanza che è entrata nel corpo, dalle sue proprietà fisiche e chimiche, dalla durata dell'assunzione e dalle reazioni chimiche nel corpo.
L'effetto tossico dipende dalle caratteristiche biologiche della specie, dal sesso, dall'età e dalla sensibilità individuale dell'organismo, dalla struttura e dalle proprietà fisico-chimiche del veleno, dalla quantità
sostanza caduta nel corpo, fattori ambientali (temperatura, pressione atmosferica, ecc.).
Pertanto, la ramificazione della catena di atomi di idrocarburi indebolisce l'effetto tossico rispetto agli isomeri non ramificati, mentre l'introduzione di un gruppo ossidrile nella molecola riduce la tossicità (gli alcoli sono meno tossici dei corrispondenti idrocarburi). L'introduzione di un alogeno in una molecola di un composto organico ne aumenta la tossicità, ecc.
La sensibilità delle specie ai veleni di vari organismi è molto diversa, a causa delle peculiarità del metabolismo, del peso corporeo, ecc. C'è una certa differenza nella formazione dell'effetto tossico a seconda del sesso: c'è una maggiore sensibilità nelle donne all'azione dei solventi organici, e men che meno ai composti del boro, del manganese. Alcuni veleni sono più tossici per i giovani, mentre altri lo sono più per gli anziani. La sensibilità individuale è determinata dallo stato di salute.
In alcuni casi intermittente L'azione (intermittente) del veleno aumenta l'effetto tossico. Un aumento dell'effetto lgzhico sul corpo umano si osserva con un aumento della temperatura, dell'umidità e della pressione barometrica. Con un significativo attività fisica c'è un aumento della ventilazione dei polmoni, che porta ad una distribuzione intensiva della sostanza tossica nel corpo. Anche il rumore e le vibrazioni possono aumentare l'effetto tossico.
La classificazione tossicologica generale dei veleni industriali comprende i seguenti tipi di effetti sugli organismi viventi:
- tossico generale (coma, edema cerebrale, convulsioni): alcol e suoi surrogati, monossido di carbonio;
- agente nervino (convulsioni, paralisi): nicotina, alcuni pesticidi, OS;
- riassorbitivo cutaneo (infiammazione locale in combinazione con effetti tossici generali): essenza acetica, dicloroetano, arsenico;
- soffocante(edema cerebrale tossico): ossidi di azoto, alcuni OM;
- lacrimoso e irritante (irritazione delle mucose degli occhi, del naso, della gola): vapori di acidi e alcali forti;
^100- psicotropo(attività mentale compromessa, coscienza): farmaci, atropina;
- sensibilizzante (allergie): formaldeide, solventi, vernici;
- mutageno(violazione del codice genetico, alterazioni delle informazioni ereditarie): piombo, manganese, isotopi radioattivi;
- cancerogeno(causa tumore maligno): cromo, nichel, amianto;
- teratogeno(influiscono sulla funzione riproduttiva e fertile): mercurio, piombo, stirene, acido borico.
Gli ultimi tre tipi di esposizione a sostanze nocive - mutageniche, cancerogene e teratogene - sono indicate come conseguenze a lungo termine dell'influenza dei composti chimici sul corpo. Questo azione specifica, che si manifesta non durante il periodo di esposizione e non immediatamente dopo la sua fine, ma in periodi remoti, anni e anche decenni dopo. Si nota la comparsa di vari effetti, e nelle generazioni successive, soprattutto per le sostanze con proprietà mutagene.
Inoltre, i veleni hanno anche una tossicità selettiva, cioè presente maggior pericolo per un determinato organo o sistema corporeo. Secondo la tossicità selettiva, i veleni si distinguono:
- che colpisce il cuore. Questi includono molti farmaci, veleni vegetali, sali metallici (bario, potassio);
- che colpiscono il sistema nervoso e causando disturbi dell'attività mentale. Si tratta di alcol, droghe, monossido di carbonio, alcuni pesticidi;
- accumulandosi nel fegato. Tra questi vanno distinti gli idrocarburi clorurati, i funghi velenosi, i fenoli e le aldeidi;
- accumulandosi nei reni. Queste sono connessioni metalli pesanti, glicole etilenico, acido ossalico;
- influenzando il sangue. Si tratta dell'anilina e dei suoi derivati, i nitriti;
- che colpisce i polmoni. Questi sono ossidi di azoto, ozono, fosgene;
- accumulandosi nelle ossa e che influenza la creazione del sangue: lo stronzio.
Per un ampio gruppo di aerosol (polveri) che non presentano una tossicità pronunciata, va notato effetto fibrogenico azioni sul corpo. Questi includono aerosol di carbone, coke, fuliggine di diamanti, polveri di origine animale e vegetale, polveri contenenti silicati e silicio, aerosol di disintegrazione e condensazione di metalli.
Entrando negli organi respiratori, le sostanze di questo gruppo danneggiano la mucosa del tratto respiratorio superiore, che porta allo sviluppo della bronchite. Perdurando nei polmoni, la polvere provoca la rinascita tessuto polmonare V tessuto connettivo e cicatrici (fibrosi) dei polmoni. Malattie professionali associate all'esposizione ad aerosol - pneumoconiosi e bronchite cronica da polvere: occupano il secondo posto in termini di frequenza tra tutti malattie professionali in Russia.
La presenza di un effetto fibrogenico non esclude l'effetto tossico generale degli aerosol. Le polveri velenose includono aerosol del pesticida DDT, piombo, berillio, arsenico, ecc. Se entrano nel sistema respiratorio, oltre ai cambiamenti locali nelle vie respiratorie superiori vie respiratorie, si sviluppa un quadro di avvelenamento acuto e cronico.
Nella produzione si riscontra raramente un effetto isolato di sostanze nocive, di solito un dipendente è esposto a un effetto combinato di fattori negativi di diversa natura (fisici, chimici, fattori di gravità e intensità di lavoro) o a un effetto combinato di fattori dello stesso natura, ad esempio, un gruppo di sostanze chimiche. Azione combinata- questo è un effetto simultaneo o sequenziale sul corpo di più veleni con la stessa via di ingresso. Ne esistono diversi tipi azione combinata veleni a seconda degli effetti della tossicità:
Pubblicato sulla rivista:
PRATICA PEDIATRICA, FARMACOLOGIA, giugno 2006
Dottore S.S. POSTNIKOV, Professore, Dipartimento di Farmacologia Clinica, Università Medica Statale Russa, Mosca Purtroppo non esistono farmaci innocui e, inoltre, a quanto pare, non possono esserci. Pertanto, continuiamo a parlare degli effetti collaterali di uno dei gruppi di farmaci più prescritti: gli agenti antibatterici.
AMINOGLICOSIDI (AMG)
Gli aminoglicosidi includono composti che contengono 2 o più aminozuccheri legati da un legame glicosidico al nucleo della molecola, l'amminociclitolo.
La maggior parte dei primi AMG sono AB naturali (funghi del genere Streptomices e Micromonospore). L'ultima AMG- amikacina (derivato della kanamicina A) e netilmicina (derivato semisintetico della gentamicina) ottenute per modificazione chimica di molecole naturali.
Gli AMH svolgono un ruolo importante nel trattamento delle infezioni causate da organismi Gram-negativi. Tutti gli AMG, sia vecchi (streptomicina, neomicina, monomicina, kanamicina) che nuovi (gentamicina, tobramicina, sisomicina, amikacina, netilmicina) hanno un ampio spettro d'azione, attività battericida, proprietà farmacocinetiche simili, caratteristiche simili di reazioni avverse e tossiche ( oto- e nefrotossicità)) e interazione sinergica con β-lattamici (Soyuzpharmacy, 1991).
Quando somministrati per via orale, gli AMH sono scarsamente assorbiti e pertanto non vengono utilizzati per trattare le infezioni al di fuori del tubo intestinale.
Tuttavia, l'AMG può essere ampiamente assorbito (soprattutto nei neonati) se applicato localmente dalla superficie del corpo dopo l'irrigazione o l'applicazione e avere un effetto nefro- e neurotossico (effetto sistemico).
L'AMH attraversa la placenta, si accumula nel feto (circa il 50% della concentrazione materna) con possibile sviluppo di sordità totale.
NEFROTOSSICITÀ DELL'AMH
Gli AMH quasi non subiscono biotrasformazione e vengono escreti dal corpo principalmente attraverso filtrazione glomerulare. È indicato anche il loro riassorbimento da parte dei tubuli prossimali. A causa della via di eliminazione prevalentemente renale, tutti i rappresentanti di questo gruppo sono potenzialmente AB nefrotossico(fino allo sviluppo di necrosi tubulare con insufficienza renale acuta), solo in vari gradi. Su questa base, l'AMH può essere organizzato nel seguente ordine: neomicina > gentamicina > tobramicina > amikacina > netilmicina (E.M. Lukyanova, 2002).
La nefrotossicità dell'AMH (2-10%) si sviluppa più spesso nei gruppi di età polare (bambini piccoli e anziani) - effetto tossico dipendente dall’età. La probabilità di nefrotossicità aumenta anche con l'aumento della dose giornaliera, della durata del trattamento (più di 10 giorni) e della frequenza di somministrazione e dipende dalla precedente disfunzione renale.
Gli indicatori più informativi di danno ai tubuli prossimali (bersaglio degli effetti tossici dell'AMH) sono la comparsa nelle urine di microglobuline (β 2 -microglobulina e α 1 -microglobulina), che normalmente vengono quasi completamente riassorbite e catabolizzate dall'organismo. tubuli prossimali ed enzimi (livelli aumentati di N-acetil-β -glucosaminidasi), nonché proteine con un peso molecolare superiore a 33 KD, che vengono filtrate dai glomeruli. Di norma, questi marcatori si riscontrano dopo 5-7 giorni di trattamento, sono moderatamente pronunciati e reversibili.
Violazione della funzione di escrezione di azoto da parte dei reni come manifestazione insufficienza renale(un aumento del livello di urea e creatinina sierica di oltre il 20%) viene rilevato solo con danno renale significativo dovuto all'uso prolungato di dosi elevate di AMH, potenziamento della loro nefrotossicità da parte dei diuretici dell'ansa e / o dell'amfotericina B.
GENTAMICINA: i reni accumulano circa il 40% degli AB distribuiti nei tessuti del paziente (più dell'80% degli AB “renali” nella corteccia renale). Nello strato corticale dei reni, la concentrazione di gentamicina supera quella osservata nel siero del sangue di oltre 100 volte. Va sottolineato che la gentamicina è caratterizzata da più alto grado riassorbimento tubulare e maggiore accumulo nello strato corticale dei reni rispetto ad altri AMG. La gentamicina si accumula anche (anche se in quantità minori) nel midollo e nelle papille dei reni.
La gentamicina, assorbita dai tubuli prossimali dei reni, si accumula nei lisosomi delle cellule. Essendo nelle cellule, inibisce la fosfolipasi lisosomiale e la sfingomielinasi, che causano fosfolipidosi lisosomiale, accumulo di particelle mieloidi e necrosi cellulare. Uno studio al microscopio elettronico nell'esperimento e una biopsia dei reni nell'uomo hanno rivelato gonfiore dei tubuli prossimali, scomparsa dei villi dell'orletto a spazzola, cambiamenti negli organelli intracellulari con l'introduzione della gentamicina nel mezzo dosi terapeutiche. Il trattamento con dosi elevate (>7 mg/kg al giorno) di gentamicina può essere associato a necrosi tubulare acuta con insufficienza renale acuta e necessità di emodialisi in alcuni casi, della durata di una fase oligurica di circa 10 giorni, con pieno recupero funzione renale dopo la sospensione del farmaco.
I fattori che aumentano la possibilità di nefrotossicità da gentamicina comprendono: pregressa insufficienza renale, ipovolemia, uso contemporaneo di altri farmaci nefrotossici (idrocortisone, indometacina, furosemide e acido etacrinico, cefaloridina, ciclosporina, amfotericina B), sostanze radiopache; età del paziente.
L'incidenza delle reazioni nefrotossiche durante il trattamento con gentamicina varia dal 10-12 al 25% e persino al 40%, a seconda della dose e della durata del trattamento. Queste reazioni si osservano più spesso alla concentrazione massima di AB nel sangue di 12-15 µg/ml. Tuttavia, viene sottolineata l'opportunità di determinare le concentrazioni minime (residue), poiché un aumento di questi valori superiore a 1-2 μg/ml prima di ogni somministrazione successiva è prova di accumulo del farmaco e, quindi, di possibile nefrotossicità. Da qui la necessità monitoraggio dei farmaci per AMG.
OTOTOSSICITÀ DELL'AMH
Quando si usano streptomicina, gentamicina, tobramicina, si verificano spesso disturbi vestibolari e la kanamicina e il suo derivato amikacina influenzano principalmente l'udito. Tuttavia, questa selettività è puramente relativa e tutti gli AMG presentano uno spettro “ampio” di ototossicità. Pertanto, la gentamicina penetra e persiste a lungo nel fluido dell'orecchio interno, nelle cellule dell'apparato uditivo e vestibolare. La sua concentrazione nell'endo- e perilinfa è molto più alta che in altri organi e si avvicina alla concentrazione nel sangue, e al livello di 1 μg / ml rimane lì per 15 giorni dopo l'interruzione del trattamento, causando cambiamenti degenerativi nelle cellule esterne dell'epitelio ciliato del giro principale della coclea (Yu.B. Belousov, S.M. Shatunov, 2001). IN quadro clinico questi cambiamenti corrispondono a un deterioramento dell'udito nei toni acuti e, man mano che la degenerazione progredisce verso la parte superiore della coclea, anche nei toni medi e bassi. Le prime manifestazioni reversibili dei disturbi vestibolari (dopo 3-5 giorni dall'inizio del farmaco) comprendono: vertigini, tinnito, nistagmo, coordinazione compromessa. Con l'uso prolungato di AMG (più di 2-3 settimane), la loro escrezione dal corpo rallenta con un aumento della concentrazione nell'orecchio interno, a seguito della quale possono svilupparsi gravi cambiamenti invalidanti negli organi dell'udito e dell'equilibrio. Tuttavia, nel caso della gentamicina, non è stata riscontrata una correlazione sufficiente tra la sua concentrazione nell'orecchio interno e il grado di ototossicità e, a differenza della kanamicina, della monomicina e della neomicina, durante il trattamento con gentamicina praticamente non si sviluppa la sordità. Allo stesso tempo, ci sono marcate variazioni tra gli AMH nell’incidenza di questi disturbi. Pertanto, in uno studio su 10.000 pazienti, è stato riscontrato che l'amikacina causa la perdita dell'udito nel 13,9% dei casi, la gentamicina nell'8,3% dei pazienti, la tobramicina nel 6,3% e la neomicina nel 2,4%. La frequenza dei disturbi vestibolari è rispettivamente pari a 2,8; 3.2; 3,5 e 1,4%.
Le reazioni ototossiche durante il trattamento con gentamicina si sviluppano molto meno frequentemente negli adulti che nei bambini. Teoricamente, i neonati corrono un rischio maggiore di sviluppare reazioni ototossiche a causa dell'immaturità dei meccanismi di eliminazione e di una velocità di filtrazione glomerulare inferiore. Tuttavia, nonostante l’uso diffuso della gentamicina nelle donne in gravidanza e nei neonati, l’ototossicità neonatale è estremamente rara.
Gli effetti tossici uditivi e vestibolari della tobramicina sono associati anche al sovradosaggio, alla durata del trattamento (>10 giorni) e alle caratteristiche del paziente: funzionalità renale compromessa, disidratazione, assunzione di altri farmaci che presentano ototossicità o ostacolano l'eliminazione dell'AMH.
In alcuni pazienti, l'ototossicità potrebbe non manifestarsi clinicamente, in altri casi i pazienti avvertono vertigini, tinnito, perdita di percezione dei toni alti con il progredire dell'ototossicità. I segni di ototossicità di solito iniziano a comparire molto tempo dopo la sospensione del farmaco: un effetto ritardato. Tuttavia, è noto un caso (V.S. Moiseev, 1995) in cui l'ototossicità si è sviluppata dopo una singola iniezione di tobramicina.
AMIKACIN. La presenza in prima posizione della molecola di amikacina - acido 4-ammino-2-idrossibutirril-butirrico fornisce non solo protezione di AB dall'azione distruttiva della maggior parte degli enzimi prodotti da ceppi batterici resistenti, ma causa anche meno ototossicità rispetto ad altri AMG ( eccetto metilmicina): uditivo - 5%, vestibolare - 0,65% per 1500 trattati con questo AB. Tuttavia, in un'altra serie di studi (10.000 pazienti) controllati mediante audiometria, è stata dimostrata una frequenza di disturbi dell'udito vicina a quella della gentamicina, sebbene nell'esperimento si sia scoperto che l'amikacina, come altri AMG, penetra nell'orecchio interno e provoca alterazioni degenerative nell'orecchio interno. sulle cellule ciliate, tuttavia, come nel caso della gentamicina, non è stata riscontrata alcuna relazione tra la concentrazione di amikacina nell’orecchio interno e il grado di ototossicità. È dimostrato anche questo cellule ciliate dei sistemi uditivo e vestibolare sono sopravvissuti nonostante il fatto che la gentamicina fosse stata trovata all’interno delle cellule e 11 mesi dopo l’interruzione del trattamento. Ciò dimostra che non esiste una correlazione semplice tra la presenza di AMH e danni agli organi dell'udito e dell'equilibrio. Questo è il motivo per cui è stato suggerito che alcuni pazienti abbiano una predisposizione genetica agli effetti dannosi dell'AMH (MG Abakarov, 2003). Questa posizione è stata confermata dalla scoperta nel 1993 in 15 pazienti con perdita dell'udito di 3 famiglie cinesi (dopo trattamento AMG) della mutazione genetica A1555G della posizione dell'RNA 12S che codifica per gli enzimi mitocondriali, che non è stata rilevata in 278 pazienti senza perdita dell'udito che avevano anche ricevuto AMG. Ciò ha portato alla conclusione che l'uso dell'AMH è un fattore scatenante per il rilevamento fenotipico di questa mutazione.
Negli ultimi anni è diventato sempre più popolare un nuovo regime posologico per l’AMH: una singola somministrazione dell’intera dose giornaliera di gentamicina (7 mg/kg) o tobramicina (1 mg/kg) tramite infusione di 30-60 minuti. Ciò deriva dal fatto che gli AMH hanno un effetto battericida concentrazione-dipendente e quindi il rapporto Cmax/mic > 10 è un adeguato predittore dell'effetto clinico e batteriologico.
L'efficacia del nuovo metodo di somministrazione dell'AMH è stata dimostrata per infezioni di varia localizzazione: addominale, respiratoria, genito-urinaria, cutanea e dei tessuti molli, sia acuta che cronica (fibrosi cistica). Tuttavia, le concentrazioni di picco di AMH che si verificano con questo regime di dosaggio, spesso superiori a 20 μg/ml, possono teoricamente creare una minaccia di nefro- e ototossicità. Intanto studi di D. Nicolau, 1995; K. Kruger, 2001; T. Schroeter et al, 2001 mostrano che una singola somministrazione di AMH non solo non è inferiore, ma addirittura superiore in termini di sicurezza rispetto all'uso abituale di AMH per 3 volte, probabilmente a causa di un periodo di washout più lungo.
TETRACICLINE
Tetracicline - osteotropico e quindi accumularsi tessuto osseo, soprattutto giovani, proliferanti. Nell'esperimento sui cani è stata osservata la deposizione di tetraciclina anche nei denti permanenti.
A causa della loro lipofilicità, le tetracicline penetrano la barriera placentare e si depositano nelle ossa del feto (sotto forma di complessi chelati con calcio privi di attività biologica), cosa che può essere accompagnata da un rallentamento della loro crescita.
L'uso di antibiotici tetraciclinici nei bambini in età prescolare in alcuni casi porta alla deposizione di farmaci nello smalto dei denti e nella dentina, che causa l'ipomineralizzazione dei denti, il loro scurimento (scolorimento), l'ipoplasia dello smalto dei denti, un aumento della frequenza della carie e la comparsa di carie. perdita. L'incidenza di queste complicanze nell'uso delle tetracicline è di circa il 20%.
In caso di uso imprudente o errato di tetracicline in dosi elevate (più di 2 g al giorno), tubulotossicità(necrosi tubulare) con insufficienza renale acuta e necessità, in alcuni casi, di emodialisi.
Pertanto, l'uso delle tetracicline nelle donne in gravidanza, durante l'allattamento (la tetraciclina penetra nel latte materno) e i bambini sotto gli 8 anni di età non sono raccomandati.
Riassumendo quanto sopra, vorrei sottolineare ancora una volta che qualsiasi medicinale (e quindi gli antibiotici) è un'arma a doppio taglio, che, tra l'altro, è stata notata e riflessa nella definizione dell'antico russo, dove la parola "pozione" era usato in un doppio significato - e come guarigione, E come veleno. Pertanto, iniziando la farmacoterapia, in futuro non si dovrebbe lasciare il paziente solo con il medicinale, dicendogli (come spesso accade nella stessa clinica) "bevilo (il medicinale) per una o due settimane e poi torna". Per alcuni pazienti, questo "più tardi" potrebbe non arrivare. Concentrati nella tua mente medica su effetto terapeutico, noi (forse inconsapevolmente noi stessi) sminuiamo l'importanza dell'altro la regola più importante trattamento: la sua sicurezza. Questa perdita di vigilanza ci rende impreparati ad agire quando si verificano reazioni avverse, che a volte possono portare a conseguenze irreparabili.
L'effetto tossico dovrebbe essere attribuito all'interruzione del ciclo dell'urea durante lo sviluppo iniziale dell'iperammonemia.
Uno dei sintomi: prima che si verifichi un coma profondo, spesso si sviluppano convulsioni, soprattutto in tenera età.
Tuttavia, quando buon controllo disturbi metabolici, convulsioni sintomatiche sono rari.
Nella fenilchetonuria incurabile si possono distinguere i seguenti disturbi del metabolismo degli aminoacidi. Le statistiche dicono che tali crisi epilettiche si sviluppano nel range dal 25% al 50% di tutti i pazienti esaminati.
Sindrome di West ben studiata con ipsaritmia e convulsioni infantiliè il sintomo più comune, che viene completamente curato con la nomina della terapia sintomatica.
Alcune crisi epilettiche possono essere accompagnate dalla cosiddetta malattia dello sciroppo d'acero nel periodo neonatale; in questo caso, sull'elettroencefalogramma appare un ritmo “a cresta”, simile al ritmo nelle regioni centrali del cervello.
Quando viene prescritta una dieta adeguata, le convulsioni cessano e l’epilessia non si sviluppa. In alcuni disturbi del metabolismo degli aminoacidi, le convulsioni possono essere uno dei sintomi principali.
Esiste un tipo di convulsioni tossiche dovute a disturbi metabolici acidi organici, dove una varietà di aciduria organica può essere al centro di un attacco o portare a episodi di scompenso acuto. Tra queste, le più significative sono l’acidemia propionica e l’acidemia metilmalonica.
 Durante un trattamento corretto, le convulsioni sono molto rare e riflettono un danno cerebrale persistente. Nell'aciduria glutarica di tipo 1, le crisi epilettiche possono svilupparsi in modo acuto e cessare dopo l'inizio di una terapia adeguata.
Durante un trattamento corretto, le convulsioni sono molto rare e riflettono un danno cerebrale persistente. Nell'aciduria glutarica di tipo 1, le crisi epilettiche possono svilupparsi in modo acuto e cessare dopo l'inizio di una terapia adeguata.
Con una carenza di 2-metil-3-idrossibutirrato-CoA deidrogenasi, descritta come una malattia congenita dell'acido responsabile dell'obesità brachiocefalica e del metabolismo alterato dell'isoleucina, si verifica spesso una grave epilessia.
Un'altra vista crisi epilettiche a causa degli effetti tossici è causato da una violazione del metabolismo delle pirimidine e del metabolismo delle purine. Tali attacchi sono caratteristici della carenza di adenil succinato, i cui effetti “de novo” provocano la sintesi delle purine.
Tuttavia, va notato che l'epilessia si sviluppa molto spesso nel periodo neonatale e nel primo anno di vita di una persona. In tali pazienti vengono inoltre rilevati disturbi psicomotori pronunciati e autismo.
La diagnosi viene effettuata utilizzando il test di Bratton-Marshall modificato, utilizzato per esaminare le urine. Va detto che non esiste un trattamento efficace questa malattia pertanto, la prognosi medica è molto sfavorevole. Le statistiche mostrano che le convulsioni si sviluppano nel 50% di tutti i pazienti esaminati con deficit di diidropirimidina deidrogenasi.
E viene notato il tipo finale di crisi epilettiche dovute a effetti tossici pratica medica come iperglicemia non chetotica.
 Questo disturbo è causato da un'insufficiente degradazione della glicina e si manifesta abbastanza precocemente, nel periodo neonatale, con sintomi quali letargia, ipotensione, singhiozzo (rilevato circa prima della nascita), nonché oftalmoplegia.
Questo disturbo è causato da un'insufficiente degradazione della glicina e si manifesta abbastanza precocemente, nel periodo neonatale, con sintomi quali letargia, ipotensione, singhiozzo (rilevato circa prima della nascita), nonché oftalmoplegia.
Va notato che con l'aggravamento del coma, iniziano a svilupparsi apnea e frequenti contrazioni convulsive miocloniche focali. Nel corso dei mesi successivi (di solito più di tre) si sviluppa una sindrome grave, di difficile successione, che nella maggior parte dei casi si manifesta con convulsioni motorie parziali o spasmi infantili.
In tenera età, l'elettroencefalogramma mostra un'attività di fondo normale, ma sono presenti aree di onde acute epilettiche (i cosiddetti lampi depressivi), seguite da attività lenta di elevata ampiezza con ipsaritmia nei successivi tre mesi.
La diagnosi si basa su alta concentrazione glicina in tutti i liquidi corporei e nel liquido cerebrospinale (valore > 0,08). Con l'aiuto di un tomografo a risonanza magnetica viene mostrato un quadro normale oppure ipoplasia o agenesia.
La glicina è uno dei più grandi inibitori dei neurotrasmettitori nel midollo spinale e nel cervello. È stato suggerito che un eccesso di glicina saturi eccessivamente il sito di legame del coantagonista del recettore NMDA, contribuendo all'eccessiva eccitazione della neurotrasmissione e alla tossicità postsinaptica.
L'effetto tossico eccitatorio studiato di un recettore NMDA iperattivo è una causa evidente di epilessia, nonché di tetraplegia parziale e ritardo mentale. Ciò è confermato da studi terapeutici con antagonisti NMDA con manifestazioni parziali all'elettroencefalogramma. Una forma così grave di epilessia, come dimostra la pratica, viene trattata con farmaci antiepilettici convenzionali. 
Va ricordato che anche la classificazione dell'epilessia tiene conto criterio dell'età. Con l'aiuto di esso, si distinguono l'esordio tipico, precoce, che appare nei primi giorni di vita, e l'esordio atipico, tardivo, che si manifesta all'età di 35 anni.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0