Il trapianto di microbiota fecale (FMT), o trapianto fecale, è un metodo di trattamento in cui il materiale fecale del donatore dopo addestramento speciale messo su una persona malata.
Il primo trapianto di feci fu eseguito nel 1958 e viene eseguito sugli animali da oltre 100 anni. Ad esempio, i veterinari curano cavalli e mucche per una serie di malattie intestinali.
Perché è necessario un trapianto fecale?
Ci sono studi che riportano buoni effetti colite da clostridi - infezione intestinale causata da Clostridium difficile (la sua forma grave è la colite pseudomembranosa). Esistono dati preliminari sull'impatto del trapianto fecale sul quadro clinico della sclerosi multipla, del morbo di Crohn, della colite ulcerosa e della diabete. Tutto ciò che collega queste malattie è la complessa comunità batterica dell’intestino. Tutta l'essenza del trattamento ruota attorno a questa complessa microbiocenosi.
Gli scienziati sottolineano giustamente che i batteri non sono l'unico fattore nelle feci dei donatori. Virus, archaea, funghi, protozoi, nonché cellule epiteliali intestinali insieme a prodotti metabolici: tutto questo "miscuglio" può svolgere un ruolo significativo nel meccanismo del trapianto fecale.
La composizione delle feci umane
La composizione della materia fecale non è stata ancora studiata in modo approfondito. Gli studi di composizione furono condotti principalmente negli anni '70-'80 del secolo scorso. In media, le feci sono composte per il 75% di acqua e per il 25% di solidi. La maggior parte La componente solida è un materiale organico costituito dal 30-45% di cellule microbiche, morto e vivo.
In concentrazioni significative vengono determinati archeobatteri, funghi e protozoi. Uno dei tipi di archeobatteri, il Methanobrevibacter smithii che produce metano, è stato rilevato nel 96% dei pazienti e può rappresentare fino al 10% di tutti gli anaerobi fecali. Mentre il loro contributo all'effetto trapianto fecale non si è presentato.
batteri. se si parla di batteri nelle feci, allora la loro concentrazione è molto elevata, e raggiunge le 10^11 cellule per grammo di feci umide. Tuttavia dallo studio sono emersi punti importanti per il metodo di trapianto: il 49% dei batteri è vitale. Metà cellule batteriche materiale donatore e questo rappresenta circa il 3-6,6% della materia fecale totale. E sebbene un certo numero di batteri muoia anche sotto l'azione dell'aria DNA batterico i batteri morti possono svolgere una funzione immunostimolante. Non meno importante: il materiale donatore può essere congelato: l'effetto non viene perso in seguito.
Virus. Ora sul rilevamento dei virus nelle feci. Questa è la componente meno esplorata. Ci sono circa 10 volte meno virus che batteri. Rispetto ad altri media, i virus si trovano comunemente in natura più batteri 1,5-160 volte, cioè nell'intestino si manifestano in modo molto più modesto. Batteriofagi (virus, batteri dannosi). Uno dei batteriofagi più comuni -. L’impatto dei fagi sulla salute umana è ora oggetto di attiva considerazione. Nell'esperimento con la terapia fagica, sono stati rilevati una diminuzione del numero di cellule di clostridio e una diminuzione della produzione di tossine (sebbene il numero di spore di questi batteri sia aumentato).
Archebatteri e funghi. In generale, è riconosciuta da tempo, ma in termini di quantità, una piccola parte del microbioma umano (anche se, se parliamo di metanoarchaeon, il loro numero è pari al 10% dell'intera flora anaerobica e aumenta con sclerosi multipla e morbo di Crohn). I funghi vengono coltivati nel 70% degli adulti sani e rappresentano lo 0,03% di tutti i microbi presenti nelle feci. Il rappresentante più comune candida albicans, fungo del lievito. Sono pochissimi, poiché il numero viene normalmente tenuto sotto controllo. batteri intestinali. Quando sbilanciati, questi funghi possono causare malattie intestinali, rompendosi. Candida albicans alta concentrazione trovato nella malattia di Crohn e nella CU. Ma per ora funghi e archeobatteri sono oggetto di studio.
Colonociti umani. Ma questo è interessante. Le cellule epiteliali del colon vengono isolate in uno stato vitale ad una concentrazione di 10 mln. cellule per grammo di feci. La sopravvivenza dei colonciti è legata alla loro capacità di assumere una forma globulare (sferica). Perché questo è importante? Il fatto è che qualsiasi infiammazione della parete intestinale è associata a danni a queste cellule. E più velocemente viene ripristinata la mucosa intestinale, meglio è. In recenti esperimenti sui topi è stato effettuato il trapianto di cellule staminali intestinali e si è rivelato che queste cellule si integrano facilmente (“mettono radici”) in un nuovo posto. E sebbene le cellule staminali non siano state ancora identificate nelle feci (ci sono studi secondo cui queste cellule penetrano nel lume intestinale), possono influenzare il successo del trapianto fecale.
Prodotti metabolici nelle feci. È noto da tempo che le fibre nell’intestino vengono utilizzate dai batteri per sintetizzare la catena corta acidi grassi(butirrati), che hanno proprietà antinfiammatorie e immunomodulanti. Inoltre, queste sostanze costituiscono un substrato energetico per i colonciti.
La fibra aumenta la quantità di materia fecale e una diminuzione della sua quantità porta alla "fame microbica". Quindi mangia più fibre. Ciò aumenta la diversità microbica e aumenta la quantità di butirrati benefici (acetato, butirrato, propionato), migliora condizione clinica in pazienti con aspecificità colite ulcerosa. Inoltre, nutrire topi sperimentali con colite con butirrato di sodio riduce l’infiammazione e il danno alla mucosa.
procedura di trapianto fecale
Il trapianto fecale avviene solitamente mediante colonscopia e, meno comunemente, mediante un tubo naso-intestinale e capsule speciali. Durante una colonscopia, il dispositivo si muove attraverso l'intero colon, quindi viene eseguita l'introduzione del materiale donatore.
Requisiti dei donatori per il trapianto di feci
I donatori non devono essere stati esposti ad antibiotici negli ultimi 6 mesi
- Non avrebbero dovuto indebolire l'immunità
- Non avere tatuaggi e piercing negli ultimi sei mesi
- Non avere problemi di droga
- Non avere contatti sessuali con alto rischio
Il donatore non deve visitare aree endemiche poco prima della raccolta
- non ho malattie infiammatorie intestino (morbo di Crohn e colite ulcerosa)
Gli affitti dei donatori analisi generale sangue, analisi per epatite A, B e C, sifilide. Viene eseguita un'analisi delle feci per le uova di elminto, Clostridium difficile, vengono fornite le feci per la microflora e un antigene per Girdia.
A proposito, non è affatto necessario che il donatore sia vicino al paziente (marito o moglie) o sia suo parente.
Trapianto fecale: quali sono le preoccupazioni
Considerati i dati raccolti fino ad oggi, il metodo del trapianto fecale ha ben poco effetti collaterali. È stato segnalato un solo caso artrite reumatoide e la malattia di Sjögren, ma gli scienziati non vedono una relazione diretta con questa tecnica. Il rischio rimane, ma questi rischi sono insignificanti.
Finalmente
Il metodo non è ancora concesso in licenza in Russia. Tutte le ricerche e le applicazioni del trapianto fecale vengono effettuate all'estero. Su Internet vengono descritti molti casi di utilizzo della tecnica da parte dei pazienti a casa. Nel nostro Paese ancora in status metodologia sperimentale tenuto presso lo Stato centro scientifico coloproctologia a Mosca e Novosibirsk. Sembra sciocco, ma ci sono controversie, cosa dovrebbe essere considerato materiale fecale? Finora è considerato un materiale da trapianto con tutto il quadro giuridico pertinente.
Tuttavia, si può essere certi che il metodo diventerà molto più comune nei prossimi anni.
Chirurgo Palamarchuk
Se trovate un errore di battitura nel testo, fatemelo sapere. Evidenziare una parte di testo e fare clic Ctrl+Invio.
Colleen R. Kelly, Stacy Kahn, Purna Kashyap, Loren Laine, David Rubin, Ashish Atreia, Thomas Moore, Gary Wu Gastroenerology journal. vol. 149, numero 1, pag. 223-237, 2015
È noto che il microbiota intestinale coevolve con l’umanità da migliaia di anni ed è parte integrante della fisiologia umana, che svolge un ruolo significativo nel metabolismo, nel funzionamento sistema immunitario e il mantenimento dell’omeostasi intestinale. Il trapianto fecale (trapianto di microbiota fecale - FMT) è la somministrazione di materiale fecale contenente microbiota intestinale distale proveniente da persona sana(donatore) a un paziente con una malattia o condizione associata a disbiosi o disturbo della composizione microflora normale intestini. L'obiettivo della FMT è curare le malattie ripristinando la diversità filogenetica e la composizione della microflora caratteristica delle persone sane. Negli ultimi 2-3 anni, FMT ha attirato attivamente l'attenzione dei ricercatori. Un gran numero di segnalazioni, studi retrospettivi e semplici studi randomizzati controllati hanno dimostrato il beneficio della FMT per i pazienti con infezione grave o ricorrente da Clostridium difficile, con un tasso di guarigione che raggiunge il 100%, con un tasso di recupero medio dell’87-90%. Il numero di casi descritti di FMT nel mondo oggi supera i 500 casi. Inoltre, il mantenimento a lungo termine dello spettro microbico in un paziente simile a un donatore dopo la FMT ha portato a ipotizzare che la FMT possa rivelarsi utile in altre condizioni associate alla disbiosi, come la malattia infiammatoria intestinale, la sindrome metabolica e altre. L'articolo presentato è dedicato alla FMT, alla metodologia e ai potenziali meccanismi di influenza sull'infezione da Cl.difficile e su altre malattie. Vengono inoltre presentati i dati, inclusa una panoramica dei rischi reali e teorici di questa procedura. Inoltre, l'articolo discute le prospettive della terapia microbica e la formazione di protocolli e raccomandazioni in quest'area in rapido sviluppo.
Storia del TFM
Il trapianto fecale ha le sue origini nella Cina del IV secolo, dove per il trattamento veniva utilizzata una sospensione orale fecale avvelenamento del cibo E forme gravi diarrea, e fin dal XVII secolo trova largo impiego in medicina veterinaria per la cura delle patologie del rumine (stomaco dei ruminanti). Ci sono state anche segnalazioni aneddotiche in tempi moderni sull'uso delle feci dei genitori per trattare la diarrea associata agli antibiotici nei bambini. Questi rapporti iniziarono a ricevere maggiore attenzione solo dopo la pubblicazione di Ben Iseman, un chirurgo americano, che pubblicò un articolo nel 1958 descrivendo quattro pazienti con colite pseudomembranosa. Per molti anni la terapia FMT è stata utilizzata molto raramente, se non addirittura dimenticata. Primo pubblicazione scientifica confermando la guarigione di Cl. difficile utilizzando FMT è comparsa nel 1983. Da allora, un numero crescente di serie di casi e di studi randomizzati e controllati in singolo cieco che descrivono la somministrazione efficace di feci di donatori mediante varie manipolazioni, prevalentemente nel trattamento di pazienti recidivi o refrattari nel solito modo trattamento dell'infezione da Cl.difficile. È stato inoltre notato che la FMT consente l'uso di metodi tecnologicamente semplici e relativamente economici per il trattamento di questa complessa unità nosologica. Nonostante l'ampio accumulato esperienza positiva, dati provenienti da centinaia di casi pubblicati, la FMT non è attualmente una tecnica comunemente utilizzata. Elevata efficienza dell'FMT nel trattamento dell'infezione da Cl.difficile, nonché nella descrizione dei casi risultato positivo uso della FMT nel trattamento degli altri disturbi intestinali, hanno portato ad un crescente interesse nell'uso della FMT per il trattamento di altre condizioni associate alla disbiosi, come la sindrome metabolica, l'obesità, allergie alimentari, malattie infiammatorie intestinali, sindrome dell'intestino irritabile. Attualmente in movimento ricerche cliniche dedicato a questi temi.
Principi di base e metodi di trattamento
Indicazioni
Nel 2010 si sono formati membri di diverse associazioni mediche specializzate interessate alla FMT gruppo di lavoro al fine di sviluppare raccomandazioni sull’uso della FMT per i medici praticanti. Sono state formulate le seguenti indicazioni per la FMT:
- Infezione ricorrente di tipo Cl.difficile
- tre o più episodi di infezione da CL.difficile da lieve a grado medio gravità e mancanza di risposta a un ciclo di vancomicina di 6-8 settimane con graduale declino dosi con/senza l'uso di alternative agenti antibatterici(rifaximina, nitazoxanide, fidaxomicina).
- almeno due episodi di infezione grave da Cl.difficile che hanno richiesto il ricovero ospedaliero.
- Infezione Cl.difficile di moderata gravità senza risposta terapia standard(vancomicina o fidaxomicina) per 1 settimana ed eventualmente;
- Infezione grave (inclusa quella fulminante) da Cl.difficile senza risposta alla terapia standard entro 48 ore.
Le linee guida del 2013 dell'American College of Gastroenterology per il trattamento dell'infezione da Clostridium difficile hanno indicato che l'FMT è un'alternativa terapeutica per i casi ricorrenti in cui è stato utilizzato un regime di riduzione graduale della vancomicina. Le prove disponibili non raccomandano inequivocabilmente l'FMT per il trattamento di forme gravi e complicate (ad esempio, megacolon tossico), sebbene diversi articoli pubblicati presentino l'FMT come sicuro e sicuro. terapia efficace anche per i pazienti condizione critica. Naturalmente, i pazienti con grave infezione da Cl.difficile risultano avere rischio maggiore esito negativo e, di conseguenza, la decisione di eseguire la FMT rispetto alla chirurgia o ad altri interventi dovrebbe essere presa con cautela.
Selezione dei donatori
Il donatore può essere un partner sessuale, un amico o un volontario di età superiore ai 18 anni. Sebbene i bambini possano anche agire come donatori con il consenso dei genitori e l'approvazione del bambino stesso. Allo stesso tempo, viene considerato ottimale qualsiasi donatore che sia adatto in base ai risultati. ricerca di laboratorio, dati anamnestici e non prevede criteri di esclusione specifici. Quando si sceglie un donatore, è necessario tenere conto di tutti i vantaggi e gli svantaggi. I partner sessuali (ad esempio i coniugi) sono avvantaggiati rispetto ai fattori di rischio comuni ambiente, che riduce significativamente il rischio di trasmissione di un agente infettivo. Vantaggio del parente linea materna come donatore consiste nella somiglianza delle caratteristiche con il ricevente del microbiota intra-intestinale. Si può anche presumere che come donatori siano preferibili gli uomini, perché il sesso femminile è più spesso associato a malattie autoimmuni dell'intestino e alla sindrome dell'intestino irritabile. Alcuni medici ritengono che l’età e il sesso possano rappresentare un vantaggio, sebbene non vi siano prove a sostegno di ciò. Infine, i donatori non imparentati, sani, ma ben selezionati possono avere un vantaggio, soprattutto quando la FMT viene utilizzata per trattare malattie in cui predisposizione geneticaè di fondamentale importanza, come, ad esempio, nel caso delle malattie infiammatorie intestinali. Avere un donatore sano e attentamente selezionato può contribuire notevolmente riuscito TFM. Potrebbe addirittura essere preferibile un donatore non consanguineo, poiché un membro della famiglia potrebbe essere costretto a donare e negare fattori di rischio rilevanti. Inoltre, in connessione con le ipotesi emergenti secondo cui la microflora intra-intestinale potrebbe essere potenzialmente coinvolta nella patogenesi malattie sistemiche, un volontario sano attentamente selezionato può avere numerosi vantaggi. Il trapianto di microbiota da un tale donatore consente di ridurre al minimo i rischi di contrarre una condizione patologica da parte del ricevente, il che è particolarmente importante se il paziente è giovane.
Screening dei donatori
I potenziali donatori dovrebbero essere attentamente selezionati malattie infettive. Dovrebbero essere identificati i fattori che aumentano il rischio di infezione (come l’uso di farmaci). Si suggerisce di utilizzare un questionario per il donatore, che assomiglia al modulo di protocollo per un donatore di sangue. Inoltre, il donatore non deve avere alcuna malattia o condizioni patologiche, che teoricamente può essere espulso con le feci. I donatori idonei vengono sottoposti a test sierologico e fecale per agenti infettivi, preferibilmente entro 4 settimane prima della donazione. Come minimo, il donatore deve sottoporsi agli esami elencati nelle prime due colonne della Tabella 1. Esame aggiuntivo dovrebbe essere effettuato in alcuni casi casi clinici come, ad esempio, se il destinatario ha uno sconto stato immunitario o in altre situazioni in cui il donatore può essere una potenziale fonte di infezione.
|
Tabella 1. Screening dei donatori proposto |
|||
|
Sedia |
Possibile ricerca |
||
|
Virus dell’epatite A/immunoglobulina M |
Tossina B del C. difficile (preferibilmente polimerasi reazione a catena) |
Citomegalovirus |
|
|
Ricerca sui patogeni flora intestinale |
Cryptostemmatidi |
virus T-linfotropico umano |
|
|
Anticorpi contro il virus dell'epatite C |
Isospore e ciclospore |
Virus Epstein-Barr |
|
|
Virus dell'immunodeficienza 1 e 2 test immunoassorbente collegato |
E.coli O157 |
Dientamoeba fragilis |
|
|
Test anticardiolipina |
Rotavirus |
Blastocitosi |
|
|
Listeria |
Strongiloidosi |
||
|
norovirus |
Helicobacter |
||
|
Schistosomi |
|||
|
Enterococco resistente alla vancomicina (VRE) |
|||
|
Staphylococcus aureus resistente alla meticillina |
|||
Criteri di esclusione dei donatori:
- Anamnesi di trattamento antibiotico nei 3 mesi precedenti la donazione.
- Storia malattie gastrointestinali tra cui la malattia infiammatoria intestinale, la sindrome dell’intestino irritabile, costipazione cronica, tumore maligno Tratto gastrointestinale e Intervento chirurgico sul tratto gastrointestinale.
- Storia di malattia autoimmune o atopica o terapia immunomodulante in corso.
- Storia della sindrome dolore cronico(fibromialgia, sindrome fatica cronica) o patologico condizioni neurologiche e condizioni associate a uno sviluppo neurologico compromesso.
- Sindrome metabolica, obesità (indice di massa corporea >30 kg/m2) o deperimento.
- Disponibilità malattie maligne o un trattamento antitumorale in corso.
Preparazione del materiale e dei metodi di ricerca
Il materiale deve essere sciolto e omogeneizzato in una forma adatta alla somministrazione. Diversi studi non mostrano una differenza significativa nel successo dell’FMT se le feci vengono mescolate con acqua, latte o soluzione salina (sterile, priva di germi), anche se si presume che salamoia minore impatto sul microbiota del campione del donatore. Il campione del donatore viene quindi omogeneizzato (utilizzando un frullatore, manualmente, ecc.) e, se necessario, filtrato (ad esempio rete, filtro del caffè, ecc.). Questo campione elaborato viene inserito direttamente nel tratto gastrointestinale o spremuto, inserito in capsule di gelatina e ingerito. Esiste anche la pratica di congelare il microbiota fecale, che viene poi scongelato per l’uso. Come per la preparazione delle feci, non esiste un'opinione precisa sul metodo di introduzione del materiale. Il materiale può essere introdotto divisioni superiori Gastrointestinale (endoscopia, sondini o capsule nasogastrici/nasointestinali), in parti prossimali colon attraverso un colonscopio reparti distali colon con un clistere, una sonda rettale, un rettoscopio o può essere utilizzato metodo combinato introduzioni. Il metodo nasogastrico o nasointestinale è scomodo e meno attraente per il paziente. Potrebbe essere richiesto esame radiografico per confermare il corretto posizionamento del tubo. Queste manipolazioni possono causare nausea e difficoltà respiratorie. Un clistere è relativamente poco costoso e meno rischioso, ma alcuni pazienti hanno difficoltà a trattenere il materiale del donatore, richiedendo iniezioni multiple. Metodo endoscopico La somministrazione (colonscopia) è abbastanza ben tollerata e ha il vantaggio di consentire di esaminare la mucosa del colon ed escludere patologie della mucosa (IBD, infezione Cl.difficile). Il metodo endoscopico aumenta il rischio della procedura e aumenta il costo della procedura. Allo stesso tempo, in generale, la FMT non è una procedura molto costosa (costo inferiore con maggiore efficienza). La FMT è efficace in tutte le opzioni presentate e il metodo preferito dipende dalla situazione clinica. Meno metodi invasivi come un clistere o un'infusione naso-intestinale possono essere più sicuri per un paziente debilitato o gravemente malato. Blocco intestinale costituisce una controindicazione all'introduzione di materiale nel tratto gastrointestinale superiore.
L'efficacia del trattamento dell'infezione da Cl.difficile
I risultati della FMT sono stati studiati in pazienti giovani e anziani con una bassa frequenza malattie concomitanti, comprese le condizioni immunosoppressive. Le procedure sono state eseguite senza complicazioni, con alta efficienza e ben tollerato dai pazienti. Il ruolo finale dell'FMT nel trattamento dell'infezione da Cl.difficile in situazioni diverse non è ancora chiaro, anche se attualmente è noto in gran numero casi di trapianto. La FMT ha dimostrato una risposta rapida alla terapia con un tasso di guarigione di circa il 90%. Assenza reazione positiva non dipendeva dal metodo di somministrazione. Esperienza generale si basava su rapporti di serie di casi. Ad oggi, è stato condotto un solo semplice studio randomizzato e controllato. Questo studio condotto nei Paesi Bassi ha dimostrato un tasso di successo dell'81% dell'efficace infusione duodenale di feci di donatori nel trattamento di Cl. somministrazione orale vancomicina. Inoltre, l’FMT si è dimostrato sicuro, senza effetti collaterali significativi. Cammarota et al. è stato affermato che il metodo di introduzione del materiale nel colon (colonscopia, clistere) ha portato a risultati migliori rispetto all'introduzione nel tratto gastrointestinale superiore (gastroscopia, sondini nasogastrici e nasointestinali) (rispettivamente 84% -93 e 81% -86) . Tuttavia, un esame più attento delle modalità di somministrazione non ha mostrato grandi differenze. Gruppo di studio sui problemi clinica generale del Massachusetts hanno valutato l'efficacia della somministrazione di materiale fecale da donatore sano pari a 15 compresse congelate per os per 2 giorni a pazienti con infezione ricorrente da Clostridium difficile. È stato raggiunto un livello di efficienza del 90%, rendendo la somministrazione orale un'alternativa alla somministrazione fecale. metodo endoscopico, che ha ridotto significativamente i costi e le possibili complicazioni.
Meccanismi d'azione
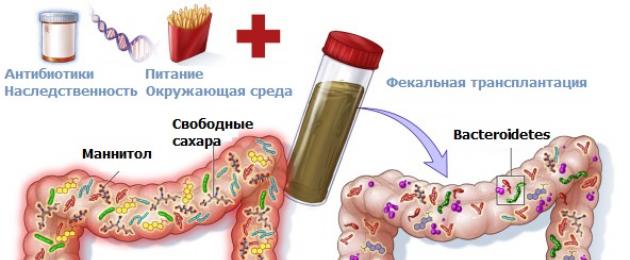
Cl.difficile è un organismo opportunista che causa malattie negli esseri umani sopprimendo la propria normale microflora, solitamente con l'uso di antibiotici. Inoltre, gli studi hanno dimostrato che i pazienti con recidiva di Cl. difficile sono private di quei tipi di batteri che solitamente dominano nel colon (Fig. 1). TFM è il massimo trattamento efficace infezione ricorrente da C difficile, sebbene i meccanismi esatti questo effetto sono ancora in fase di studio.

Il principale fattore di rischio per lo sviluppo dell'infezione da Cl.difficile è l'uso di antibiotici, sebbene l'infezione non si sviluppi in tutti i pazienti che assumono antibiotici. L'assunzione di antibiotici porta alla soppressione della normale microflora intestinale. Uno studio precedente che indagava l’effetto degli antibiotici sulla funzione del microbiota del colon ha mostrato una diminuzione dell’attività dell’urobilinogeno e della tripsina fecale, nonché una diminuzione della conversione del colesterolo in coprosterolo dopo il trattamento antibiotico. È interessante notare che questi cambiamenti sono iniziati dopo il trapianto fecale da un individuo sano con livelli elevati di urobilinogeno e coprosterolo. Dethlefsen et al. ha esaminato l'effetto della ciprofloxacina su tre misure e ha riscontrato una riduzione della diversità tassonomica microbica, composizione quantitativa flora e uniformità di distribuzione, sebbene questi indicatori differissero in ciascun paziente. Esperimenti più recenti su topi iniettati con cefoperazone hanno dimostrato che il trattamento antibiotico altera il metabolismo fecale associato ad alterate funzioni del microbiota. Nei topi si è verificato un aumento dei livelli di acidi biliari primari, un aumento dei livelli di alcol zuccherino di mannitolo e sorbitolo, una diminuzione dei livelli di acidi grassi a catena corta, media e lunga, un aumento dei livelli di aminoacidi acidi come glicina, prolina, cisteina e isoleucina. Tutti questi cambiamenti contribuiscono alla crescita di Cl.difficile. Le differenze nell’incidenza dell’infezione da Cl.difficile dopo l’uso di antibiotici possono essere associate all’effetto individuale dell’antibiotico sul microbiota, alle caratteristiche del paziente e al tipo di antibiotico. Sebbene gli antibiotici siano il principale fattore di rischio per l'infezione da Cl.difficile, lo sviluppo dell'infezione è possibile senza la loro prescrizione. Attualmente non ci sono informazioni sufficienti sul microbiota intestinale, ma si può presumere che oltre alle caratteristiche dell’ospite, alla dieta e alle condizioni ambientali, la disfunzione gastrointestinale in generale possa ridurre la diversità microbica intestinale, modificare la funzione microbica, promuovendo la crescita di Cl.difficile. In futuro, potrebbe essere possibile determinare i cambiamenti tassonomici che si verificano dopo l’FMT per comprendere meglio come l’innesto influisce sull’ecologia microbica del colon. Come si è scoperto, l’FMT favorisce la colonizzazione a lungo termine della mucosa da parte di nuovi tipi di batteri donatori, nonché un aumento del numero di batteri precedentemente esistenti nella mucosa. piccole quantità specie normale. I meccanismi che determinano la diminuzione dell’attività di Cl.difficile dopo FMT non sono ancora del tutto chiari, ma includono sicuramente l’esclusione di nicchie di agenti patogeni, la ricerca di nutrienti, la creazione di un ambiente che non è favorevole alla crescita di agenti patogeni, la capacità di un intestino sano microbiota per produrre sostanze che inibiscono la crescita di Cl. difficile, nonché una maggiore produzione di secondario acidi biliari. Un fattore importante il successo del trapianto fecale è il ripristino della diversità microbica dopo il trattamento. Inoltre, i cambiamenti nella struttura della comunità microbica, come il ripristino delle principali specie di Firmicutes e Bacteroidetes con una diminuzione del numero di Proteobatteri, contribuiscono allo spostamento di Cl.difficile. La diminuzione quantitativa del contenuto di Lachnospiraceae è associata a forme gravi di Cl. infezioni difficili. La somministrazione di una soluzione contenente Lachnospiraceae è stata utilizzata per trattare l'infezione nei topi. Inoltre, dopo il successo dell'FMT, viene ripristinato il numero di Lachnospiraceae e di altri microrganismi produttori di butirrato, che svolgono un ruolo chiave nello spostamento di Cl.difficile. Bacillus thuringiensis produce batteriocina, turicina CD con attività strettamente mirata contro i batteri gram-positivi, incluso Cl. Difficile. Il contenuto di acidi biliari può influenzare significativamente la crescita di Cl.difficile. L'acido biliare primario (taurocolato) favorisce la germinazione delle spore di Cl.difficile. Weingarden et al. hanno evidenziato un aumento del contenuto di acidi biliari secondari nelle feci dopo FMT. Studi più recenti di Buffie et al. hanno dimostrato che l'introduzione di Clostridium scindens, contenente un gene che codifica per la 7-idrossisteroide deidrogenasi necessaria per la sintesi degli acidi biliari secondari, facilita il decorso dell'infezione da Cl.difficile nei topi.
FMT nella malattia infiammatoria intestinale (IBD)
Nonostante il fatto che la componente microbica della malattia infiammatoria intestinale sia molto più complessa e diversificata rispetto all’infezione ricorrente da Cl.difficile, il trattamento delle IBD basato sull’impatto sul microbioma intestinale è vasta area per la ricerca. Nel 1900 si è scoperto che i batteri giocano ruolo essenziale con colite. Dopo un secolo di ricerca e sviluppo, stiamo appena iniziando a comprendere le basi microbiologiche delle IBD e la necessità di FMT e di altri trattamenti microbiologici. Le moderne tecnologie molecolari hanno mostrato le principali differenze nello spettro microbico e nel funzionamento del microbioma nei pazienti con IBD. La disbiosi è caratterizzata da una diminuzione della diversità delle specie, con riduzione significativa il contenuto di batterioidi e batteri del gruppo Lachnospiraceae, un aumento del contenuto di proteobatteri e attinobatteri. Gli studi hanno anche dimostrato una diminuzione della concentrazione di Faecalibacterium prausnitzii, che ha un ruolo nell'effetto antinfiammatorio nella malattia di Crohn. L’FMT riflette l’approccio della modulazione non mirata della disbiosi nelle IBD. Una recente revisione sistematica e meta-analisi di 18 studi che includevano 122 pazienti con IBD sottoposti a FMT hanno dimostrato un tasso di remissione del 45%. Sebbene il tasso sia sceso al 36,2% quando sono stati esclusi i dati delle serie di casi. Risultati totali in termini di risultati remissione clinica erano più elevati nei pazienti giovani (7-20 anni) e nei pazienti con malattia di Crohn rispettivamente nel 64,1% e nel 60,5%. Questo studio ha anche dimostrato che, nonostante il fatto che l’FMT non abbia effetti collaterali gravi, un certo numero di pazienti ha manifestato un aumento della temperatura corporea, brividi, sintomi gastrointestinali: flatulenza, nausea, diarrea e aumento sensibilità al dolore nell'addome. Alcuni pazienti con colite ulcerosa sono peggiorati dopo una sessione di FMT. Inoltre, sono stati presentati casi di esacerbazione della colite ulcerosa e del morbo di Crohn dopo FMT, sollevando molte domande sulla sicurezza e sul rischio di peggioramento. Recentemente sono stati condotti anche due studi controllati con placebo. In uno studio di Moayyedi et al. Settantacinque pazienti con colite ulcerosa attiva sono stati randomizzati a un FMT settimanale e un clistere d'acqua di 6 settimane. C’era una differenza statisticamente significativa tra i due gruppi. Remissione (scala Mayo)<3 и полное заживление слизистой) была достигнута у 24% пациентов в группе ТФМ и 5% пациентов в группе плацебо. У пациентов в группе ТКФ было отмечено больше микробное разнообразие после лечения. В следующем исследовании, проведенном в Амстердаме, участвовало 50 рандомизированных пациентов с легкой и среднетяжелой формой язвенного колита, которым через назодуоденальный зонд вводился донорский кал и аутогенный фекальный трансплантат. ТФМ была проведена в начале исследования и спустя 3 недели. Только 37 пациентов дошли до первичной конечной точки исследования (эндоскопическая ремиссия по шкале Майо на 12 неделе). В уровне клинических и эндоскопических ремиссии между двумя группами значимых различий выявлено не было. Вероятно, данное исследование не было достаточно объемным для выявления достоверных различий. Первоначальных результатов оказалось недостаточно для утверждения того, что ТФМ или воздействие другими компонентами кишечной микрофлоры необходимы для лечения ВЗК. Множество факторов влияет на конечный результат, включая форму ВЗК, вариабельность состава донорского материала, дозу материала и частоту проведения ТФМ и сопутствующей терапии. В будущем, возможно, ТФМ будет заменена специальными манипуляциями и/или селективной трансплантацией определенных микробных спектров, помогающих восстановить нормальную микробиоту кишечника, что в свою очередь положительно повлияет на течение ВЗК.
Obesità
L’obesità è un’epidemia globale. La mancanza di una terapia efficace e non chirurgica ha portato alla necessità di indagare i fattori che contribuiscono allo sviluppo dell’obesità. Esistono diversi fatti sul ruolo del microbiota del colon nello sviluppo dell’obesità. Sono state dimostrate differenze significative nel microbiota intestinale tra persone magre e obese. Il trapianto del microbiota intestinale dai tipi magri a quelli grassi studiati può riassumere il fenotipo metabolico nei topi sterili. È stato dimostrato che l’uso di antibiotici nelle prime fasi della vita predispone all’obesità in modelli animali. Il trapianto di microbiota intestinale dopo bypass gastrico Roux-en-Y in topi sterili determina una perdita di peso, a differenza del trapianto di microbiota dopo un intervento chirurgico fittizio (placebo). Gli esatti meccanismi attraverso i quali il microbiota intestinale contribuisce allo sviluppo dell’obesità rimangono poco chiari, anche se dati recenti forniscono informazioni importanti. Il microbiota intestinale può fermentare i carboidrati alimentari e fornire all’ospite energia aggiuntiva attraverso la sintesi di acidi grassi a catena corta. Tuttavia, è noto che il microbiota dei topi sottopeso produce più acidi grassi a catena corta rispetto ai topi obesi, quindi si può presumere che la causa dell’eccesso di peso non sia solo la sintesi aggiuntiva di molecole ad alta intensità energetica, ma l’influenza di il sistema neuroormonale del tratto gastrointestinale, che può modificare il dispendio energetico, e i meccanismi associati alla formazione della fame. Un recente studio in doppio cieco, randomizzato e controllato ha dimostrato che dopo il trapianto di microbiota intestinale da soggetti obesi, si è verificato un aumento della sensibilità all’insulina e un aumento della diversità del microbiota intestinale con un aumento della produzione di butirrato. Lo studio pilota indica una direzione per ulteriori lavori utilizzando il trapianto fecale o una comunità microbica specifica per il trattamento dell'obesità, della sindrome metabolica e del diabete mellito.
Sindrome dell’intestino irritabile (IBS)
La sindrome dell’intestino irritabile è una delle malattie croniche più comuni del tratto gastrointestinale, che colpisce circa il 20% del Nord America. La fisiopatologia dei sintomi dell’IBS non è ancora del tutto compresa, ma è noto che nella patogenesi sono coinvolti meccanismi centrali e periferici. Diversi studi dimostrano cambiamenti significativi nel microbioma intestinale nei pazienti con IBS. Questi cambiamenti sono molto probabilmente dovuti allo studio eterogeneo e alla differenza nella preparazione dei campioni e nelle metodologie di test. La diminuzione rivelata della diversità microbica nell’IBS assomiglia a cambiamenti simili nell’IBD, nell’obesità e nell’infezione da Cl.difficile. Studi recenti suggeriscono che i cambiamenti nel microbiota intestinale potrebbero essere responsabili dei meccanismi alla base dell’IBS: ipersensibilità viscerale, ridotta funzione di barriera, alterata motilità intestinale, alterata comunicazione intestino-cervello. Pertanto, il microbiota intestinale è oggetto di uno studio approfondito al fine di ottimizzare il trattamento di disturbi funzionali come l’IBS, data la varietà dei regimi terapeutici attualmente utilizzati: prebiotici, probiotici, dieta, antibiotici, ecc. Molti studi mostrano dinamiche positive nei pazienti con IBS dopo TFM. Ad esempio, in uno studio, il 90% dei pazienti dopo FMT ha mostrato un miglioramento in termini di normalizzazione dei movimenti intestinali e riduzione della flatulenza. Nel 60% dei pazienti è stato osservato un risultato a lungo termine da 9 a 19 mesi. Sebbene questi studi siano incoraggianti, va ricordato che i dati presentati provengono da diversi studi non controllati e sono soggetti a errori statistici. Per determinare il ruolo dell’FMT e di altri tipi di batterioterapia nel trattamento dell’IBS, è necessario condurre studi randomizzati, controllati e di alta qualità.
Altre indicazioni per FMT
Oltre alle malattie sopra descritte, sono attivi studi che valutano la possibilità di utilizzare l'FMT in altre malattie: sindrome metabolica, diabete mellito di tipo II, fegato grasso, infezioni da agenti patogeni multiresistenti, encefalopatia epatica, malattie allergiche nei bambini. Ad esempio, l’Università della California, a San Francisco, sta arruolando pazienti con infezione da HIV in terapia antiretrovirale in uno studio per valutare l’impatto del trapianto di microbiota sulle risposte immunitarie e sull’alterazione dei biomarcatori infiammatori.
Sicurezza FMT
L’FMT è stato adattato per il trattamento dell’infezione da Clostridium difficile prima del completamento di ampi studi qualitativi, quindi è difficile giudicare in modo affidabile la presenza di effetti collaterali. I potenziali effetti collaterali possono essere suddivisi in categorie: a breve e lungo termine; quelli a breve termine possono inoltre essere suddivisi in quelli direttamente legati alla tecnica di somministrazione (colonscopia, sedazione) e quelli direttamente legati al trapianto di flora. Gli effetti collaterali a breve termine sono più associati alla FMT, soprattutto nei pazienti con infezione ricorrente da Cl.difficile. Vale la pena prestare attenzione a queste conclusioni, tenendo presente che i dati primari sono ottenuti da studi retrospettivi. Inoltre, non vengono fornite informazioni sufficienti sulla sicurezza a lungo termine dell’MTF. Vengono presentati i risultati degli studi che includevano serie di casi di più di 5 pazienti con infezione da Cl.difficile (Tabella 2).
Tavolo 2
|
Metodo di amministrazione |
Osservazione |
Effetti collaterali |
|
|
infusione duodenale |
Diarrea - 5; colica - 5; eruttazione - 3; nausea - 1; i sintomi si sono risolti entro 3 ore |
||
|
Sondino nasogastrico o colonscopia |
Leggero fastidio allo stomaco/eruttazione - 4; febbre (il giorno 2) - 1 |
||
|
Sondino nasogastrico |
Nessun effetto collaterale |
||
|
Sondino nasogastrico |
Nessun effetto collaterale “correlato al trapianto”; sanguinamento nel tratto gastrointestinale superiore entro 1 mese dopo FMT |
||
|
Sondino nasogastrico |
Peritonite sullo sfondo della dialisi peritoneale il giorno 3 (morte); polmonite in un paziente con malattia polmonare cronica ostruttiva (morte il giorno 14) |
||
|
Colonscopia |
Nessun effetto collaterale |
||
|
Colonscopia |
Nessun effetto collaterale grave; 1/3 presenta disturbi di stomaco e grave flatulenza durante le prime due settimane dopo l'FMT |
||
|
Colonscopia |
1 complicanza: “microperforazione” a seguito di biopsia colonscopica, recupero senza intervento chirurgico |
||
|
Colonscopia |
3 settimane - 8 anni |
Nessun effetto collaterale |
|
|
Colonscopia, 11; sonda nasoduodenale, 1 |
Nessun effetto collaterale |
||
|
Enteroscopia e colonscopia |
Debole manifestazione di febbre - 5; eruttazione - 3; eliminato entro 12-24 ore |
||
|
Nessun effetto collaterale significativo; 10% - breve stitichezza e flatulenza |
|||
|
Catetere rettale |
Alcuni pazienti sperimentano costipazione a breve termine (immediatamente dopo l'FMT) |
||
|
Nessun effetto collaterale ad eccezione di 1 paziente con sindrome dell'intestino irritabile post-infettiva |
|||
|
Colonscopia |
Non installato |
Infezione da norovirus - 2 (2 e 12 giorni dopo FMT); infezione non durante FMT |
|
|
Misto |
Effetti collaterali potenzialmente correlati: morte: insufficienza respiratoria durante la colonscopia Ospedalizzazione: esacerbazione di IBD-4; dolore addominale dovuto alla colonscopia - 1; febbre, diarrea, encefalopatia, pancitopenia in un paziente con linfoma -1 Effetti collaterali inespressi: dolore addominale/eruttazione immediatamente dopo FMT-3; danno alla mucosa durante la colonscopia - 1; diarrea auto-terminante - 3, febbre - 1; esacerbazione delle IBD - 1 |
α - pazienti immunocompromessi (p. es., terapia immunosoppressiva per le malattie infiammatorie intestinali, trapianto d'organo, trattamento antitumorale)
Effetti collaterali a breve termine
Tra le reazioni inespresse dello stesso tipo che possono verificarsi immediatamente dopo la FMT ci sono: fastidio allo stomaco, eruttazione, flatulenza, diarrea, stitichezza, brontolio nell'addome e un temporaneo aumento della temperatura. L'influenza del metodo di somministrazione sullo sviluppo dei sintomi dopo FMT non è stata dimostrata. Esiste un solo studio randomizzato e controllato che confronta i gruppi sperimentali e di controllo. Tra i 16 pazienti sottoposti a FMT mediante diffusione duodenale e lavanda gastrica, 15 pazienti avevano diarrea, 5 avevano crampi addominali, 3 avevano eruttazione e 1 aveva nausea. Questi sintomi, osservati per 3 ore, non sono stati registrati nel gruppo di controllo, che ha effettuato solo la lavanda gastrica. La maggior parte degli effetti collaterali gravi sono legati alla procedura di somministrazione. Queste possono essere complicazioni dell'endoscopia: perforazione e sanguinamento; complicanze legate alla sedazione: aspirazione del contenuto dello stomaco. Non va esclusa nemmeno la possibilità di trasmissione di agenti patogeni enterici. Un centro ha registrato due casi di infezione da norovirus 2 e 12 giorni dopo l'FMT. Si ipotizzava che un caso fosse associato a un'infezione da parte di un membro del personale durante l'esecuzione della procedura stessa. Il secondo caso riguardava l'esposizione esterna nell'intervallo tra la FMT e la comparsa dei sintomi. Un caso di sviluppo di febbre sullo sfondo di batteriemia (E. coli) è stato registrato entro 24 ore dopo l'FMT utilizzando un colonscopio in un paziente con IBD. In precedenza, il paziente aveva avuto diversi casi di batteriemia, l'ultimo - 9 mesi prima dell'FMT. La relazione tra altri effetti collaterali gravi (peritonite in un paziente sottoposto a dialisi peritoneale, polmonite, esacerbazioni di IBD) e FMT non è stata dimostrata. Nel tentativo di quantificare l'incidenza degli effetti collaterali della FMT, Kelly et al. hanno pubblicato una revisione retrospettiva delle prestazioni della procedura nei pazienti immunocompromessi sottoposti a FMT per il trattamento dell'infezione da Clostridium difficile. Le ragioni dell'indebolimento del sistema immunitario erano diverse (IBD, condizioni dopo il trapianto di organi parenchimali e chemioterapia per i tumori). È interessante notare che in questi pazienti non sono state osservate complicanze infettive associate alla FMT. Tuttavia, si sono verificati due decessi dovuti ad aspirazione durante la procedura FMT. Una paziente è morta 13 giorni dopo l'FMT a causa di una grave polmonite, per la quale è stata trattata con antibiotici prima e dopo l'FMT. Ovviamente, questa morte non è correlata alla FMT. L'esacerbazione dell'IBD dopo FMT è stata notata nel 17% dei pazienti.
Potenziali effetti collaterali a lungo termine
I rischi principali sono associati alla trasmissione di un agente infettivo durante la FMT o allo sviluppo di una malattia/condizione associata a un cambiamento nella composizione della microflora intestinale. Teoricamente, la possibilità di trasmissione di un agente infettivo sconosciuto è improbabile, così come l'epatite virale C o l'infezione da HIV. Un rischio teorico maggiore è la trasmissione di una malattia cronica basata sui cambiamenti nel microbiota intestinale. Esistono prove di una relazione tra flora intestinale e malattie come obesità, diabete, aterosclerosi, IBD, cancro al colon, steatosi epatica non alcolica, IBS, asma, autismo. Come accennato in precedenza nell’esempio dei roditori, il trapianto di microbiota fecale può anche trasmettere il fenotipo dell’obesità. L'FMT da soggetti magri a soggetti obesi con sindrome metabolica ha comportato un aumento della sensibilità all'insulina. In relazione all’aterosclerosi, la produzione del metabolita pro-aterogenico trimetilammina N-ossido dipende dal microbiota intestinale e livelli elevati di questo metabolita sono associati a un rischio di complicanze cardiovascolari. Pertanto, esiste una ragionevole preoccupazione per i rischi a lungo termine. Per determinare ulteriormente i rischi di trasmissione di malattie croniche è necessario il follow-up clinico del paziente per molti anni, combinato con l’analisi dei campioni conservati dei donatori e dei pazienti.
Aspettative dei pazienti.
I pazienti con infezione ricorrente da Cl.difficile necessitano di cure e spesso cercano aiuto in varie comunità online. Molti sono costretti a percorrere lunghe distanze per raggiungere i centri in cui viene eseguita la FMT. Alcuni di loro ricorrono addirittura all'esecuzione di un clistere fatto in casa da un donatore di feci se non riescono a trovare un medico disposto o in grado di eseguire la FMT. In effetti, il video di YouTube che descrive l’autoamministrazione del FMT è stato visto più di 45.000 volte. Gli studi sulle aspettative dei pazienti riguardo alla FMT hanno dimostrato che i pazienti trovano questo metodo scomodo ma sono comunque disposti a considerarlo come un trattamento, soprattutto se raccomandato dal proprio medico. Questa disponibilità dei pazienti a sottoporsi al trattamento non dipende in alcun modo dalla loro precedente esperienza con FMT o dalla natura della malattia (infezione da Clostridium difficile, colite ulcerosa o pazienti sani). Ad esempio, in un sondaggio condotto su pazienti sani a cui sono stati offerti scenari ipotetici per le opzioni di trattamento per l’infezione ricorrente da Cl.difficile, l’81% dei pazienti ha scelto FMT. Allo stesso modo, un sondaggio condotto su pazienti con colite ulcerosa in una specialità ha mostrato che la stragrande maggioranza di loro era interessata o disposta a considerare la FMT come trattamento. I pazienti ricoverati in ospedale erano più disposti a sottoporsi a FMT (55% vs 34%, p = 0,035), indicando che i pazienti hanno valutato i rischi e i benefici di questa tecnica in modo appropriato. I ricercatori ritengono che questo interesse dei pazienti per la FMT rifletta la consapevolezza che si tratta del trattamento più “naturale” per le IBD, così come l’insoddisfazione per la necessità di una terapia farmacologica a lungo termine. Brandt et al hanno valutato le aspettative di 77 pazienti con infezione ricorrente da Cl.difficile e FMT; Il 97% di loro ha riferito che vorrebbe utilizzare il FMT in caso di un'altra ricaduta e il 53% sceglierebbe il FMT come trattamento primario per la prima recidiva prima di assumere antibiotici se ne avesse la possibilità. Con l’avvento di protocolli di trattamento esteticamente più gradevoli, comprese le compresse inodori, è probabile che l’FMT interessi la maggior parte dei pazienti considerati idonei all’FMT. Da un recente sondaggio tra i medici è emerso che il 40% non era pronto a provare la tecnica FMT, in attesa di ulteriori conferme sulla sua efficacia, sicurezza e accettazione da parte dei pazienti. Attualmente esiste un codice per la FMT (44705, "preparazione del microbiota fecale, inclusa la valutazione di un campione di donatore") nel libro di consultazione della terminologia medica moderna, e uno degli ostacoli all'implementazione della tecnica potrebbe essere la mancanza di finanziamenti adeguati . Pertanto, i pazienti sono disposti a provare la FMT, ma non vi è alcuna prova chiara di come i medici di varie specialità siano disposti a offrire, eseguire o indirizzare i pazienti per tale trattamento.
I campioni di feci prelevati dai donatori vengono diluiti con acqua sterile e testati per le infezioni per il successivo trapianto. Illustrazione da healthcoachpenny.com.
Numerosi studi hanno già dimostrato che il trapianto di microbiota fecale (FMT) è efficace nel trattamento e nella prevenzione delle recidive di infezioni intestinali causate da batteri. Clostridiodifficile come l'enterocolite pseudomembranosa. Questa è una malattia del retto, spesso causata dalla rottura della microflora intestinale dovuta all'uso di antibiotici, in cui si osservano più spesso diarrea grave, nausea e vomito.
Solo negli Stati Uniti i ceppi sono resistenti agli antibiotici Clostridiodifficile sono responsabili di circa 250.000 ricoveri e 14.000 decessi. Attualmente nel trattamento di questa malattia vengono utilizzati gli antibiotici metronidazolo e vancomicina; nei casi più gravi è necessario rimuovere chirurgicamente la parte interessata dell’intestino. Considerando che gli antibiotici distruggono anche la normale microflora intestinale, trattare con essi questa infezione può solo peggiorare la situazione dei pazienti. Secondo studi sugli animali, il trapianto di batteri fecali può ripristinare la normale microflora intestinale del 90%.
Questo metodo di trattamento della diarrea è conosciuto in tutto il mondo da più di mezzo secolo, ci sono circa 500 pubblicazioni scientifiche che ne dimostrano l'efficacia, tuttavia, gli studi clinici del metodo FMT, formalizzati secondo tutte le regole, sono iniziati solo di recente.
Rimedio contro la diarrea, il morbo di Parkinson e l'eccesso di peso
Negli ultimi anni è stata condotta attivamente la ricerca clinica sul trapianto di microbiota fecale. Ad esempio, nel 2012, i ricercatori dell’Henry Ford Hospital hanno studiato 49 pazienti con grave diarrea ricorrente causata da Clostridium difficile. Per la procedura è stato utilizzato un endoscopio, attraverso il quale è stata introdotta nel colon dei pazienti una soluzione omogeneizzata e filtrata, che comprendeva acqua calda e da 30 a 50 grammi di feci prelevate da donatori sani. In alcuni casi, la soluzione è stata somministrata durante la procedura di colonscopia.
Di conseguenza, il 90% dei pazienti aveva appetito già due ore dopo la procedura, entro un giorno hanno avvertito un miglioramento significativo delle loro condizioni e una settimana dopo si sentivano completamente in salute. Allo stesso tempo, entro tre mesi dalla terapia, non hanno sviluppato complicazioni o effetti collaterali di questo metodo di trattamento.
Un altro studio condotto lo scorso anno da ricercatori dell’Università di Amsterdam ha scoperto che il trapianto di feci nel tratto gastrointestinale era da tre a quattro volte più efficace degli antibiotici. Secondo un articolo pubblicato sulla rivista Giornale di medicina del New England, i ricercatori inizialmente avevano pianificato di reclutare 120 pazienti per partecipare agli studi, ma alla fine hanno deciso di interrompere gli studi a causa dell'evidente differenza nello stato di salute di entrambi i gruppi di volontari. Dei 16 membri del gruppo sottoposto al trapianto di feci, 13 si sono ripresi completamente dopo la prima procedura, altri due dopo la seconda (94%), mentre solo sette (27%) dei 26 pazienti trattati con vancomicina sono guariti. Gli stessi restanti membri di questo gruppo hanno chiesto ai medici di sottoporre loro la stessa procedura e si sono ripresi dopo una o due infusioni.
Sempre nel febbraio di quest'anno, negli Stati Uniti è stata aperta la prima banca mondiale di campioni fecali per il trattamento di pazienti affetti da grave diarrea ricorrente causata da un ceppo batterico resistente agli antibiotici Clostridium difficile.
Oltre a curare le infezioni intestinali, il trapianto di batteri fecali da donatori può aiutare a perdere peso, secondo un articolo pubblicato sulla rivista Medicina traslazionale scientifica. I ricercatori sperano, nel corso di ulteriori esperimenti, di determinare il meccanismo dell'influenza dei batteri sul processo di perdita di peso e, possibilmente, di offrire un nuovo modo non chirurgico per ridurre il peso.
Alcuni anni fa, gli scienziati australiani hanno trattato pazienti affetti sia dal morbo di Parkinson che da stitichezza con un trapianto di feci. Come hanno dimostrato i risultati dello studio, grazie alla terapia sperimentale, la gravità dei sintomi della malattia di base, tra cui parkinsonismo, sclerosi multipla, artrite reumatoide e sindrome da stanchezza cronica, è diminuita nei pazienti.
Secondo l'ipotesi degli scienziati, quando la composizione della microflora viene disturbata, vari antigeni entrano nel flusso sanguigno. Causano una reazione eccessiva del sistema immunitario, che influisce sullo sviluppo del parkinsonismo e delle malattie autoimmuni. Queste ipotesi sono confermate da altri studi. In particolare, secondo gli esperti olandesi, il trapianto fecale migliora la sensibilità all'insulina nei pazienti affetti da sindrome metabolica.
Progresso scientifico: feci in capsule
I metodi esistenti di trapianto del microbiota fecale - trapianto di feci prelevate da donatori sani attraverso un colonscopio, un sondino nasogastrico o un clistere - presentano il rischio potenziale di danni al tratto gastrointestinale e causano qualche disagio ai pazienti.
Pertanto, gli scienziati americani utilizzano il metodo orale del trapianto fecale (attraverso la bocca) nel trattamento delle infezioni intestinali. Risultati della ricerca pubblicati sulla rivista JAMA, hanno dimostrato che l'assunzione di capsule di feci congelate è altrettanto efficace e sicura nel combattere il batterio patogeno. Clostridiodifficile diarrea e infusioni fecali attraverso un colonscopio o un sondino nasogastrico.
Il nuovo approccio è il seguente: le feci dei donatori sani vengono congelate, quindi la miscela di batteri intestinali da esse ottenuta viene confezionata in capsule acido resistenti destinate alla somministrazione orale. Viene effettuata un'analisi preliminare di laboratorio di campioni fecali per varie infezioni e allergeni.
Lo studio pilota ha coinvolto 20 persone di età compresa tra 11 e 84 anni con un'infezione intestinale causata da C. difficile. Per due giorni, ciascun soggetto ha assunto 15 capsule con contenuto fecale. In 14 persone la terapia sperimentale ha portato alla completa scomparsa dei sintomi della malattia dopo un unico ciclo di due giorni. I restanti sei partecipanti allo studio sono stati sottoposti a un secondo ciclo di trattamento, dopo il quale anche le condizioni dei pazienti sono tornate alla normalità. Durante lo studio non sono stati rilevati effetti collaterali del farmaco.
Secondo gli autori dello studio, nei pazienti che necessitavano di un secondo ciclo di terapia, lo stato di salute iniziale era peggiore che negli altri pazienti. "I nostri dati preliminari indicano la sicurezza e l'efficacia del nuovo approccio", hanno osservato i ricercatori. “Ora possiamo condurre studi sempre più ampi per confermare questi dati e identificare le miscele batteriche più efficaci per la somministrazione orale”.
Il trapianto fecale, o trapianto della microflora fecale (feci), consiste nel prelevare le feci di una persona sana e introdurle in una persona malata.
Il corpo umano contiene molti batteri amici e persino benefici, in particolare nel tratto gastrointestinale (GI). Un trapianto fecale, o trapianto di microflora fecale, consiste nel prelevare le feci di una persona sana e introdurle in una persona affetta da una malattia causata da. Ad oggi, il campo di applicazione del trapianto fecale si sta espandendo attivamente: se prima, attraverso il trapianto fecale, si proponeva di trattare principalmente malattie del tratto gastrointestinale, ora questo metodo di trattamento viene utilizzato per malattie autoimmuni e neurologiche. Anche nel trattamento dell'obesità, della sindrome metabolica, del diabete, della sclerosi multipla e del morbo di Parkinson verrà presto utilizzato il trapianto di microflora fecale. Gli scienziati di tutto il mondo sono attivamente alla ricerca di aree di applicazione per una tecnica insolita e di modi per modernizzarla.
È un trattamento emergente, ma non nuovo. Nella medicina cinese, già nel 1500, il consumo di piccole dosi di feci serviva come cura per alcune malattie. La prima descrizione del trapianto fecale fu pubblicata nel 1958 da Ben Eiseman e dai suoi colleghi chirurghi del Colorado che curarono quattro pazienti critici affetti da colite pseudomembranosa fulminante, una malattia infiammatoria intestinale infettiva causata dal microrganismo Clostridium difficile. I medici non sapevano come aiutare i pazienti morenti e somministravano loro clisteri fecali, che si rivelarono un trattamento efficace.
Dopo il successo di Ben Eiseman, varie istituzioni mediche iniziarono a utilizzare il trapianto di microflora fecale come trattamento per varie malattie. Il Centro per le malattie digestive di Sydney, in Australia, offre da oltre 20 anni il trapianto di microbiota fecale come opzione terapeutica.
Il trapianto di microflora fecale ha molti sinonimi: batterioterapia fecale, trasfusione fecale, trapianto fecale, trapianto fecale, clistere fecale, ecc.
 Ad oggi sono più di 200 i casi clinici al mondo descritti nella letteratura medica, in base ai quali si può concludere che il trapianto di microbiota fecale è efficace nel 90-95% dei casi. In uno studio condotto da scienziati britannici, i cui risultati sono stati pubblicati sul New England Journal of Medicine, il 94% dei pazienti è guarito con il trapianto di microbiota fecale, mentre altri trattamenti hanno aiutato solo il 27% dei partecipanti allo studio. I risultati furono così travolgenti che i ricercatori interruppero lo studio per aiutare tutti i pazienti a ricevere il trattamento con un trapianto di microflora fecale.
Ad oggi sono più di 200 i casi clinici al mondo descritti nella letteratura medica, in base ai quali si può concludere che il trapianto di microbiota fecale è efficace nel 90-95% dei casi. In uno studio condotto da scienziati britannici, i cui risultati sono stati pubblicati sul New England Journal of Medicine, il 94% dei pazienti è guarito con il trapianto di microbiota fecale, mentre altri trattamenti hanno aiutato solo il 27% dei partecipanti allo studio. I risultati furono così travolgenti che i ricercatori interruppero lo studio per aiutare tutti i pazienti a ricevere il trattamento con un trapianto di microflora fecale.
Persone idonee al trapianto di microflora fecale
Il trapianto di microflora fecale è riconosciuto come un trattamento efficace per i pazienti affetti da clostridiosi, un'infezione acuta, antroponotica, anaerobica causata dal batterio Clostridium difficile (C. Diff).
La causa principale della clostridiosi è la terapia antibiotica. Secondo numerosi studi, anche una singola dose di antibiotici ad ampio spettro può causare diarrea e colite pseudomembranosa causata da Clostridium difficile. L'ipotesi dell'efficacia della batterioterapia fecale si basa sul concetto di intervento batterico, che si basa sulla neutralizzazione dei microrganismi patogeni da parte di batteri benefici.
Solo negli Stati Uniti, gli scienziati stimano che ogni anno vengano diagnosticati circa 3 milioni di nuovi casi di clostridium. Secondo i Centri statunitensi per il controllo e la prevenzione delle malattie, ogni anno nel paese si verificano circa 14.000 decessi causati dal batterio Clostridium difficile.
Donatori per trapianto di microflora fecale
I donatori per tale trapianto devono essere persone sane che non ne hanno assunto negli ultimi 90 giorni. La maggior parte dei pazienti sceglie i parenti prossimi per il trapianto, ma vale la pena notare che una persona che non è imparentata con il paziente può diventare un donatore.
Sono esclusi i potenziali donatori con fattori di rischio per HIV ed epatite virale. Non possono diventare donatori soggetti affetti da gravi malattie del tratto gastrointestinale, affetti da malattie autoimmuni o affetti da neoplasie maligne. I potenziali donatori devono sottoporsi a screening per HIV, epatite A, B e C, sifilide e superare un test delle feci.
Gli studi hanno dimostrato che il modo più efficace per ripristinare la microflora intestinale è un trapianto fecale da un donatore sano.
La parola "trapianto" si riferisce alla rimozione diretta di un organo da una persona e al trapianto in un'altra. Tuttavia l’espressione trapianto fecale non va presa alla lettera. Questo si riferisce al trapianto di microbi benefici. Molti trattano ancora questo metodo con pregiudizio. Ma nei principali congressi medici, i rapporti sui risultati del suo utilizzo sono di grande interesse.
Quando viene applicato?
I farmaci comuni non funzionano, soprattutto in caso di grave disfunzione intestinale, e hanno molti effetti collaterali dannosi.
Uno di questi casi è l'infezione da parte del batterio intestinale Clostridium difficile. Questa malattia è scritta nell'articolo "".
Dopo questa patologia, i pazienti sviluppano una grave diarrea. È così forte che i pazienti anziani possono persino morire. Nessun farmaco o antibiotico aiuta. Nella migliore delle ipotesi, interrompono semplicemente il processo.
Pertanto, sui pazienti di questo gruppo iniziarono ad essere condotti i primi esperimenti di trapianto fecale da un donatore sano. (Naturalmente, dopo numerosi esperimenti sugli animali, che hanno mostrato ottimi risultati).
Gli scienziati americani conducono questi studi dal 2000. Hanno dimostrato che subito dopo il trapianto di un microbiota sano, i pazienti si sentono meglio e, nei casi meno gravi, si riprendono. Se il recupero non avviene durante il primo trapianto, verrà raggiunto dopo una seconda procedura.
Ora gli scienziati di tutto il mondo stanno lavorando attivamente con questo metodo.
Oltre a trattare le infezioni intestinali, gli studi hanno dimostrato che il trapianto di batteri fecali da donatori può aiutare a ridurre il peso in eccesso, secondo un articolo pubblicato sulla rivista Science Translational Medicine. I ricercatori sperano, nel corso di ulteriori esperimenti, di determinare il meccanismo dell'influenza dei batteri sul processo di perdita di peso e, possibilmente, di offrire un nuovo modo non chirurgico per ridurre il peso.
Alcuni anni fa, gli scienziati australiani hanno proposto di curare i pazienti affetti sia dal morbo di Parkinson che dalla stitichezza con un trapianto di feci.
Dato che gli scienziati associano un gran numero di malattie a una violazione della microflora intestinale, questo metodo sarà ampiamente utilizzato come trattamento sicuro per patologie gravi, in particolare malattie associate a disordini metabolici.
Ulrich Rosnijen, primario dell'ospedale israeliano di Amburgo, ha elogiato questo metodo in un congresso medico. Ha affermato che “la procedura è talmente superiore al trattamento tradizionale che può essere raccomandata come il nuovo standard per le infezioni ricorrenti”.
Quali sono le possibili complicazioni?
Dobbiamo essere consapevoli che questa procedura deve essere eseguita in una clinica ben attrezzata e affidabile. Tutte le complicazioni riscontrate sono state causate da una scarsa selezione dei donatori e da un trattamento improprio delle feci, oppure da irregolarità nella procedura.
Queste sono complicazioni come:
- trasmissione di infezioni;
- materiale che entra nelle vie respiratorie;
- nausea e vomito;
- dolore addominale;
- gonfiore;
- aumento temporaneo della temperatura.
Requisiti del donatore
Sono già stati sviluppati i primi standard per identificare i donatori idonei alla procedura.
Devono essere esaminati tutti
- presenza di qualsiasi natura
- contagio,
- presenza di malattie infiammatorie intestinali.
Come viene eseguita la procedura?
Le feci prelevate dai donatori vengono utilizzate come materiale per il trapianto entro le successive 6-8 ore o congelate a una temperatura di meno 80 gradi. In quest'ultimo caso, viene conservato con successo per 1-8 settimane. Prima della procedura di trapianto stessa, dovrebbe essere ben scongelato, ciò richiede del tempo (2-4 ore). Dalle feci di uno o più donatori (il loro numero può arrivare a 7) e da soluzione fisiologica viene preparata una speciale sospensione liquida. Viene somministrato a pazienti con:
- clistere regolare;
- gastroscopio o colonscopio (apparecchio endoscopico);
- sondino nasogastrico (viene fatto passare attraverso il naso nello stomaco o nell'intestino tenue).
Negli Stati Uniti è già stata creata la prima banca mondiale di campioni fecali. Gli scienziati notano che i metodi di standardizzazione in questo settore non sono ancora stati sviluppati. Ritengono che ogni campione dovrebbe essere accompagnato da una storia accuratamente documentata di malattia del trapianto di feci. La mancanza di reporting e standard rigorosi rappresenta attualmente lo svantaggio di questo metodo. Tuttavia, vedono lo sviluppo del metodo nel passaggio dallo stoccaggio delle feci allo stoccaggio dei microbi isolati.
Ultimi risultati scientifici
I metodi esistenti di trapianto del microbiota fecale - trapianto di feci prelevate da donatori sani attraverso un colonscopio, un sondino nasogastrico o un clistere - presentano il rischio potenziale di danni al tratto gastrointestinale e causano qualche disagio ai pazienti.
Scienziati americani hanno proposto un metodo orale di trapianto fecale (attraverso la bocca) nel trattamento delle infezioni intestinali. I risultati di uno studio pubblicato sulla rivista JAMA hanno dimostrato che l’assunzione di feci congelate in capsule è altrettanto efficace e sicura nel controllare la diarrea causata dal batterio Clostridium difficile quanto la somministrazione di feci attraverso un colonscopio o attraverso un sondino nasogastrico.
Il nuovo approccio è il seguente: le feci dei donatori sani vengono congelate, quindi la miscela di batteri intestinali da esse ottenuta viene confezionata in capsule acido resistenti destinate alla somministrazione orale. Viene effettuata un'analisi preliminare di laboratorio di campioni fecali per varie infezioni e allergeni.
Finora sono stati condotti studi preliminari con la partecipazione di 20 persone con un'infezione intestinale causata da Clostridium diffisil. Per due giorni, ciascun soggetto ha assunto 15 capsule con contenuto fecale.
In 14 persone la terapia sperimentale ha portato alla completa scomparsa dei sintomi della malattia dopo un unico ciclo di due giorni. I restanti sei partecipanti allo studio sono stati sottoposti a un secondo ciclo di trattamento, dopo il quale anche le condizioni dei pazienti sono tornate alla normalità.
Durante lo studio non sono stati rilevati effetti collaterali del farmaco. Secondo gli autori dello studio, nei pazienti che necessitavano di un secondo ciclo di terapia, lo stato di salute iniziale era peggiore che negli altri pazienti. "I nostri dati preliminari indicano la sicurezza e l'efficacia del nuovo approccio", hanno osservato i ricercatori. Verranno ora condotti studi più ampi ed estesi per confermare questi dati e identificare le miscele batteriche più efficaci per la somministrazione orale.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0